Предельные одноатомные спирты можно получить гидратацией. Предельные одноатомные спирты, или алкоголи
ОПРЕДЕЛЕНИЕ
Предельные одноатомные спирты можно рассматривать как производные углеводородов ряда метана, в молекулах которых один атом водорода замещен на гидроксильную группу.
Итак, предельные одноатомные спирты состоят из углеводородного радикала и функциональной группы -OH. В названиях спиртов гидроксильная группа обозначается суффиксом -ол.
Общая формула предельных одноатомных спиртов C n H 2 n +1 OH или R-OH или C n H 2 n +2 O. Молекулярная формула спирта не отражает строения молекулы, поскольку одной и той же брутто-формуле могут соответствовать два абсолютно разных вещества, например молекулярная формула C 2 H 5 OH является общей и для этилового спирта и для ацетона (диметилкетона):
CH 3 -CH 2 -OH (этанол);
CH 3 -O-CH 3 (ацетон).
Так же как и углеводороды ряда метана предельные одноатомные спирты образуют гомологический ряд метанола.
Составим этот ряд гомологов и рассмотрим закономерности изменения физических свойств соединений этого ряда в зависимости от увеличения углеводородного радикала (табл. 1).
Гомологический ряд (неполный) предельных одноатомных спиртов
Таблица 1. Гомологический ряд (неполный) предельных одноатомных спиртов.
Предельные одноатомные спирты легче воды, поскольку их плотность меньше единицы. Низшие спирты смешиваются с водой во всех отношениях, с увеличением углеводородного радикала эта способность уменьшается. Большинство спиртов хорошо растворимы в органических растворителях. Спирты имеют более высокие температуры кипения и плавления, чем соответствующие углеводороды или галогенпроизводные, что обусловлено возможностью образования ими межмолекулярных связей.
Важнейшими представителями предельных одноатомных спиртов являются метанол (CH 3 OH) и этанол (C 2 H 5 OH).
Примеры решения задач
ПРИМЕР 1
| Задание | В натуральном жемчуге массовые отношения кальция, углерода и кислорода равны 10:3:12. Какова простейшая формула жемчуга? |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу:
Найдем молярные массы кальция, углерода и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Ca)= 40 г/моль, Ar(C)=12 г/моль, а М(O) = 32 г/моль. Тогда, количество вещества этих элементов равно: n (Ca) = m (Ca) / M (Ca); n (Ca) = 10 / 40 = 0,25моль. n (C) = m (C) / M (C); n (C) = 3 / 12 = 0,25 моль. n (O) = m (O) / M (O); n (O) = 12 / 16 = 0,75 моль. Найдем мольное отношение: n(Ca) :n(C):n(O) = 0,25: 0,25: 0,75= 1: 1: 3, т.е. формула соединения жемчуга имеет вид CaCO 3 . |
| Ответ | CaCO 3 |
ПРИМЕР 2
| Задание | Оксид азота содержит 63,2% кислорода. Какова формула оксида |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Вычислим массовую долю азота в оксиде: ω (N) = 100% — ω(O) = 100% — 63,2% = 36,8%. Обозначим количество моль элементов, входящих в состав соединения за «х» (азот) и «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(N)/Ar(N) : ω(O)/Ar(O); x:y= 36,8/14: 63,2/16; x:y= 2,6: 3,95 = 1: 2. Значит формула соединения азота и кислорода будет иметь вид NO 2 . Это оксид азота (IV). |
| Ответ | NO 2 |
Спирты - производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу -OH (гидроксил):
R - OH
CH 4 метан - СH 3 OH метиловый спирт
СН 3 -СН 3 этан - CH 3 -CH 2 OH этиловый спирт
Названия спиртов (номенклатура ИЮПАК)
Название спирта образуется от названия предельного углеводорода с прибавлением окончания -ол. Например, СH 3 -OH - метанол, CH 3 -CH 2 -OH - этанол,
CH 3 -CH 2 -CH 2 -OH - пропанол-1 — пропанол-2.
Выбор главной цепи
1. Главная цепь включает гидроксил.
2. Главная цепь нумеруется так, чтобы атом углерода с гидроксилом получил наименьший номер.

4-метил-2-этилпентанол-1
Одноатомный спирт - спирт, молекула которого содержит одну гидроксильную группу. Пример: СН 3 -СН 2 -СН 2 ОН
Многоатомный спирт - спирт, молекула которого содержит две или более гидроксильные группы. Пример: СН 2 ОН-СН 2 -СН 2 ОН
Количество гидроксильных групп в молекуле отражается в названии частицами ди-, три-, тетра- и т. д., поставленными перед суффиксом -ол .
CH 2 OH-CHOH-CH 2 OH
пропантриол-1,2,3 (глицерин ).
1. Температуры плавления и кипения спиртов, так же как и углеводородов, увеличиваются с ростом числа атомов углерода в молекуле, но их значения у спиртов намного больше, чем у соответствующих алканов. См. Табл. 1.
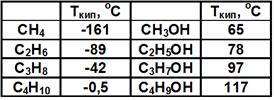
Табл. 1. Физические свойства спиртов
Причина - водородные связи между молекулами спиртов:
![]()
2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость в воде постепенно уменьшается. Табл. 2.
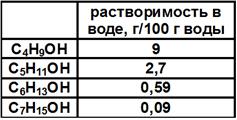
Табл. 2 Растворимость спиртов в воде.
Причина - высокая полярность спиртов, образование водородных связей между молекулами спиртов и воды:

3. Низшие спирты обладают характерным запахом. Например, кошачий запах связан с тем, что в этот запах основным компонентом входит изопропиловый спирт.

Рис. 1. Физические свойства некоторых спиртов. ()
На этом уроке вы изучили тему «Спирты. Классификация спиртов. Предельные одноатомные спирты: строение и номенклатура». Вы узнали о том, что спиртами называют углеводороды, в которых один атом углеводорода (или несколько) замещен на гидроксил, о разновидностях спиртов, об их строении.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 3, 4 (с. 85) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. М.: Просвещение, 2012.
2. Напишите структурную формулу глицерина. Назовите его по номенклатуре ИЮПАК.
3. Напишите уравнения реакций сгорания этанола.
С.Ю. Елисеев
Общая классификация спиртов. Предельные одноатомные спирты, их гомологический ряд, общая формула, изомерия, номенклатура.
Физико-химические и пожароопасные свойства спиртов;
Основные химические реакции: окисления (горение, склонность к самовозгоранию, неполное окисление); замещения (образование алкоголятов, простых и сложных эфиров, галогенпроизводных); дегидрирования и дегидратации спиртов.
Промышленные и лабораторные методы получения спиртов из углеводородов, природных сахаристых веществ, алкилгалогенидов, путем восстановления карбонильных соединений. Краткая характеристика спиртов: метилового, этилового, пропилового, бутилового, бензилового и циклогеканола.
Многоатомные спирты: изомерия, номенклатура, физико-химические и пожароопасные свойства (на примере этиленгликоля и глицерина). Основные химические реакции: окисления (горения, склонность к самовозгоранию, неполное окисление); замещение (образование алкоголятов сложных эфиров); дегидратации.
Промышленные методы получения многоатомных спиртов из полигалогенпроизводных углеводородов, путем окисления алкенов.
Простые эфиры: номенклатура, изомерия, физико-химические и пожароопасные свойства. Основные химические реакции: окисления (горение, склонность к самовозгоранию), автоокисления. Способы получения эфиров. Краткая характеристика простых эфиров: диэтилового и дипропилового.
Одноатомные спирты.
Спиртами называются производные углеводородов, представляющие собой продукты замещения атома (атомов) водорода в углеводородной молекуле гидроксильной группой –ОН. В зависимости от того, какое количество атомов водорода замещено, спирты бывают одноатомными и многоатомными. Т.е. число групп –ОН в молекуле спирта характеризует атомность последнего.
Наибольшее значение имеют предельные одноатомные спирты. Состав членов ряда предельных одноатомных спиртов может быть выражен общей формулой - СnH2n+1ОН или R-OH.
Несколько первых членов гомологического ряда спиртов и их названия по радикально-функциональной, заместительной и рациональной номенклатурам соответственно приведены ниже:
CH3OH метиловый метанол карбинол
C2H5OH этиловый этанол метилкарбинол
н-С3Н7ОН пропиловый пропанол этилкарбинол
н-С4Н9ОН бутиловый бутанол пропилкарбинол
н-С5Н11OН амиловый пентанол бутилкарбинол
По радикально-функциональной номенклатуре название спиртов образуется из названия радикалов и слова «спирт», выражающего функциональное название класса.
Международная заместительная номенклатура: к заместительному названию углеводорода, производным которого является спирт, добавляют окончание –ол (алканолы). Локант указывает номер атома углерода, при котором расположен гидроксил. Главная углеродная цепь выбирается таким образом, чтобы она включала углерод, несущий гидроксильную группу. Начало нумерации цепи так же определяет гидроксил.
Рациональная номенклатура: все спирты рассматриваются как производные метанола (СН3ОН), который в данном случае называется карбинолом: и в котором водородные атомы замещены на один или несколько радикалов. Название спирта составляют из названий этих радикалов и слова – карбинол.
Таблица 1
Изомерия и номенклатура бутиловых спиртов (С4Н9ОН)
|
Формула и строение |
Название | ||
|
Радикально- функциональное |
заместительное | рациональное | |
|
СН3-СН2-СН2-СН2 |
бутиловый спирт (первичный) |
1-бутанол | пропилкарбинол |
|
СН3-СН2-СН-СН3 |
втор-бутиловый |
2-бутанол |
метилэтил карбинол |
|
СН3-СН-СН2-ОН |
изобутиловый спирт(первичный) |
пропанол |
изопропил карбинол |
|
трет-изобутиловый |
пропанол |
триметил карбинол |
Изомерия предельных одноатомных спиртов обусловлена изомерией углеродного скелета и изомерией положения ОН- группы. Метиловый и этиловый спирты не имеют изомеров. В зависимости от положения гидроксильной группы при первичном, вторичном или третичном углеродном атоме спирты могут быть первичными, вторичными, третичными:
R-СН2-ОН R"-СН-ОН R"-C-OH
Пропиловых спирта два: СН3-СН2-СН2-ОН СН3-СН-СН3
первичный вторичный ç
(изопропиловый) ОН
Для бутанола могут быть выведены 4 изомера (см. таблицу 1);
Число изомеров в ряду спиртов быстро растет: С5-восемь изомеров, С6- семнадцать, С10- пятьсот семь.
Физические свойства
Газов в гомологическом ряду нет. Это жидкости. Начиная с С12Н25ОН до С20Н41ОН – маслообразные и с С21Н43ОН - твердые вещества.
Ткип СН3ОН=65 °С, Ткип С2Н5ОН=78 °С, r(С2Н5ОН)=0,8 г/см3
Первичные спирты изостроения имеют более низкие температуры кипения, чем нормальные первичные спирты.
В спиртах имеет место ассоциация молекул друг с другом за счет образования водородной связи. [Длина водородной связи больше обычной связи –ОН, а прочность значительно меньше (раз в 10).] Поэтому метанол-жидкость, а метан-газ. Чтобы разрушить водородные связи, надо затратить энергию; это может быть осуществлено при нагревании спирта.
Спирты легче воды: их плотности меньше 1. Метиловый, этиловый и пропиловый спирты смешиваются с водой во всех соотношениях. По мере усложнения углеводородных радикалов растворимость спиртов резко падает. Бутиловый спирт растворяется частично. Высшие спирты в воде не растворяются, т.е. выталкиваются из воды.
Из сказанного можно сделать вывод, что растворимые спирты можно тушить разбавлением (до концентрации менее 25 %); не растворимые в воде спирты водой тушить не рекомендуется, т.к. при этом спирты всплывают на поверхность воды и процесс горения продолжается. Водные растворы содержащие 25 % спирта и более - являются ЛВЖ. Следует отметить, что разбавленные растворы спиртов относятся к категории трудно горючих веществ, т.е. склонны гореть в присутствии источника зажигания.
Химические свойства
1.Спирты реагируют со щелочными металлами (Na, K и т.д.) с образованием алкоголятов:
2R-OH + 2Na ® 2R-ONa + H2
Реакция протекает не так бурно, как при использовании воды. Причем с увеличением молярной массы спирта его активность в указанной реакции уменьшается. Первичные спирты значительно активнее в реакциях со щелочными металлами, чем изомерные им вторичные и, особенно, третичные.
Спирты в данной реакции проявляют свойства кислот, но они еще более слабые кислоты, чем вода: Кдис Н2О=10-16; Кдис CH3OH=10-17; Кдис C2H5OH = 10-18. Последнее объясняется влиянием радикала на алкильную группу (R- доноры).
Практически же спирты нейтральные вещества: они не показывают ни кислой, ни щелочной реакции на лакмус, не проводят электрического тока.
2. Замещение гидроксильной группы спиртов на галоген:
R-ОН + Н-X « R-X + H2O
галогено- галоген-
водород алкил
СН3-ОН + НВr ¾® СН3-Br + Н2О
Где Н2SO4 водоотнимающее средство.
СН3-СН2-ОН + PCL5 ¾® CH3 – CH2 – CL + POCL3 + HCL
хлорокись фосфора
3СН3-СН2-ОН + PBr3 ¾® 3CH3 – CH2 – Br + P(OH)3
фосфорная кислота
3. Взаимодействие спиртов с кислотами называют реакцией этерификации. В результате ее образуются сложные эфиры:
R-OH + HO-C-R1 « R-O-C-R1 + H2O
Легче всего этерификации подвергаются первичные спирты, труднее – вторичные и наиболее трудно этерифицируются третичные спирты.
Дегидратация спиртов под действием водоотнимающих средств (H2SO4):
Внутримолекулярная: CH2 – H 160 °C CH2
½ ¾® II + H2O
CH2 – OH H2SO4 CH2
Видно, что результат реакции зависит от условий ее проведения.
Межмолекулярная: 130 °C
CH3 – CH2 – OH + HO – CH2 – CH3 ¾® CH3 – CH2 – O – CH2 – CH3
H2SO4 Простой эфир
В первом случае образующаяся вначале при смешивании H2SO4 (избыток) со спиртом алкилсерная кислота при нагревании разлагается, вновь выделяя серную кислоту и этиленовый углеводород.
Во втором случае образующаяся вначале алкилосерноя кислота реагирует со второй молекулой спирта с образованием молекулы простого эфира:
R – OH + HOSO3H ® R – OSO3H + H2O
алкилсерная кислота
R–OSO3H + HO–R ¾® R–O–R + H2SO4
5. При высокой температуре кислород воздуха окисляет спирты с образованием СО2 или Н2О (процесс горения). Метанол и этанол горят почти несветящимся пламенем, высшие – более ярким коптящим. Это связано с увеличением относительного увеличением углерода в молекуле.
Растворы KMnO4 и K2Cr2O7 (кислые) окисляют спирты. Раствор KMnO4 обесцвечивается, раствор K2Cr2O7 становится зеленым .
Первичные спирты при этом образуют альдегиды, вторичные – кетоны, дальнейшее окисление альдегидов и кетонов приводит к получению карбоновых кислот:
R-С-Н + [О] ¾® R-C-H + H2O ¾® R-C-OH
R-C-H + [O] ¾® R-C-R" + H2O ¾® R-COOH + R’- COOH
½ II + R’’-COOH
Третичные спирты в мягких условиях устойчивы к действию окислителей, в жестких условиях разрушаются, образуя при этом смесь кетонов и карбоновых кислот:
Б ½ a [O] ½ НО
СН3-С-CH2-CH3 a ¾® CH3-C=O + C-CH3 + H2O
½ б кетон О кислота
CHOOH + O=C-CH2-CH3
6. При пропускании паров первичных и вторичных спиртов над поверхностью наколенных мелкораздробленных металлов (Cu, Fe) происходит их дегидрирование: СН3-СН-Н CH3-C-H
первичный спирт альдегид
СН3-С-H ¾® CH3-C=O + H2
вторичный спирт
Способы получения
В свободном виде в природе спирты встречаются редко.
1. Большое количество этилового спирта, а также пропиловый, изобутиловый и амиловый спирты получают из природных сахаристых веществ в результате брожения. Например:
С6Н12О6 ¾¾¾® 2С2Н5ОН + 2СО2
глюкоза дрожжи
2. Из этиленовых углеводородов гидратацией:
II + ½ ¾¾® CH3-CH2-OH OH
CH2 OH Zn , H2SO4 ½
CH3-CH2-CH=CH2 + H2O ¾® CH3-CH2-CH-CH3
H2SO4 (правило Марковникова)
3. Из ацетилена гидратацией (по реакции Кучерова):
СНºСН ¾¾® СН3-СН=О ¾¾® CH3-CH2-OH
4. При гидролизе галогеналкилов:
СН3-СН2-СН2-СН2-Cl + HOH ¾® CH3-CH2-CH2-CH2OH+NaCl
(для смещения равновесия реакцию ведут в щелочной среде).
4. При восстановлении альдегидов водородом в момент выделения образуются первичные спирты, кетонов – вторичные:
R-CH + 2H ® R-CH2 (первичный спирт)
альдегид O OH
кетон ½ ½
R-C=O + 2H ® R-CH-OH (вторичный спирт)
Отдельные представители.
Метиловый спирт. Следует отметить сильную ядовитость СН3ОН. В то же время он используется как растворитель, из него получают формальдегид (необходимый для производства пластмасс), им денатурируют этиловый спирт и используют как горючее. В промышленности его получают из смеси СО и Н2 под давлением над нагретым катализатором (ZnO и др.), при сухой перегонке древесины (древесный спирт):
СО + 2Н2 ® СН3ОН (метанол)
(Пары спирта с воздухом образуют взрывоопасные смеси. ЛВЖ, Твсп.=8 оС).
От контакта с сильными окислителями (дымящая HNO3), CrO3 и Na2O2 метанол самовозгорается.
Этиловый спирт (этанол, винный спирт). Бесцветная жидкость с характерным запахом и жгучим вкусом. С водой образует азеотроп (96 % С2Н5ОН + 4 % Н2О). Химическим способом (осушая CaO, CuSO4, Ca) можно получить абсолютный спирт. Используется при получении каучуков, а также как растворитель, в парфюмерии (духи, одеколоны), горючее, дезинфицирующее средство, алкогольный напиток, на его основе готовят лекарства. (ЛВЖ, Твсп.=13 оС). С добавкой ядовитых дурно пахнущих веществ он называется денатуратом. Получают спирт в результате брожения сахаристых веществ, из целлюлозы (гидролизный спирт), гидратацией этилена в присутствии серной кислоты, восстановлением уксусного альдегида водородом, уксусный альдегид в свою очередь получают по реакции Кучерова с использованием ацетилена (см. стр. 66). Добавка метилового и этилового спиртов к моторному топливу способствует полноте сгорания топлива и устраняет загрязнение атмосферы.
Физиологически этиловый спирт действует на организм как наркотик, к которому появляется пристрастие, и который разрушает психику.
Многоатомные спирты.
Двухатомные спирты называются гликолями, трехатомные – глицеринами. По международной заместительной номенклатуре двухатомные спирты называются алкандиолами, трехатомные – алкантриолами. Спирты с двумя гидроксилами при одном углеродном атоме обычно в свободном виде не существуют; при попытках получить их они разлагаются, выделяя воду и превращаясь в соединение с карбонильной группой – альдегиды или кетоны:
СН2 ® СН2=О + Н2О
Трехатомные спирты с тремя гидроксилами при одном углеродном атоме еще более неустойчивы, чем аналогичные двухатомные, и в свободном виде неизвестны: ОН О
СН-ОН ® Н-С + Н2О
муравьиная кис-та
Поэтому первым представителем двухатомных спиртов является производное этана состава С2Н4(ОН)2 с гидроксильными группами при различных углеродных атомах – 1,2-этандиол, или иначе - этиленгликоль (гликоль). Пропану соответствует уже два двухатомных спирта – 1,2-пропадиол, или пропиленгликоль, и 1,3-пропандиол, или триметиленгликоль:
СН2-СН2 СН2-СН-СН3 СН2-СН2-СН2
½ ½ ½ ½ ½ ½
ОН ОН ОН ОН ОН ОН
этиленгликоль пропиленгликоль триметиленгликоль
(1,2-этандиол) (1,2-пропандиол) (1,3-пропандиол)
Гликоли, в которых две спиртовые гидроксильные группы расположены в цепи рядом – при соседних атомах углерода, называются a-гликолями (например, этиленгликоль, пропиленгликоль). Гликоли со спиртовыми группами, расположенными через один углеродный атом, называются b-гликолями (триметиленгликоль). И так далее.
Среди двухатомных спиртов этиленгликоль представляет наибольший интерес. Он используется в качестве антифриза для охлаждения цилиндров автомобильных, тракторных и авиационных двигателей; при получении лавсана (полиэфир спирта с терефталевой кислотой).
Это бесцветная сиропообразная жидкость, не имеющая запаха, сладкая на вкус, ядовита. Смешивается с водой и спиртом. Ткип.=197 оС, Тпл.= -13 оС, d204=1,114 г/см3. Горючая жидкость.
Дает все реакции, характерные для одноатомных спиртов, причем в них может участвовать одна или обе спиртовые группы. Вследствие наличия двух ОН-групп гликоли обладают несколько более кислыми свойствами, чем одноатомные спирты, хотя и не дают кислой реакции на лакмус, не проводят электрического тока. Но в отличие от одноатомных спиртов они растворяют гидроксиды тяжелых металлов. Например, при приливании этиленгликоля к голубому студенистому осадку Cu(OH)2 образуется синий раствор гликолята меди:
СН2-ОН CH2-O
½ + Cu(OH)2 ® ½ Cu + 2Н2О
СН2-ОН CH2-O
При действии PCl5 хлором замещаются обе гидроксидьные группы, при действии HCl – одна и образуются так называемые хлоргидрины гликолей:
СН2-СН2 CH2-CH2
½ ½ + 2PCl5 ® ½ ½ + 2POCl3 + 2HCl
этиленгликоль 1,2-дихлорэтан
СН2-СН2 СН2-СН2
½ ½ + HCl ® ½ ½ + H2O
хлоргидрин этиленгликоля
При дегидратации из 2-х молекул этиленгликоля образуется диэтиленгликоль:
НО-СН2-СН2-ОН + НО-СН2-СН2-ОН ® НО(СН2)2-О-(СН2)2ОН
кат. диэтиленгликоль
Последний, может, выделяя внутримолекулярно одну молекулу воды, превращаться в циклическое соединение с двумя группами простого эфира – диоксан: СН2-СН2-ОН СН2-СН2
О ¾® О О + Н2О
СН2-СН2-ОН СН2-СН2
диэтиленгликоль диоксан
С другой сторон, диэтиленгликоль может реагировать со следующей молекулой этиленгликоля, образуя соединение тоже с двумя группами простого эфира, но с открытой цепью – триэтиленгликоль. Последовательное взаимодействие по такого рода реакции многих молекул гликоля приводит к образованию полигликолей – высокомелекулярных соединений, содержащих множество группировок простого эфира. Реакции образования полигликолей относятся к реакциям поликонденсации.
Полигликоли используются в производстве синтетических моющих средств, смачивателей, пенообразователей.
Окисление
При окислении первичные группы гликолей превращаются в альдегидные, вторичные - в кетонные группы.
Способы получения
Этиленгликоль получают щелочным гидролизом 1,2-дихлорэтана, а последний – хлорированием этилена:
СН2=СН2 + Cl2 ® CH2Cl-CH2Cl ¾¾® CH2OH-CH2OH
(давление)
Из этилена этиленгликоль может быть получен и путем окисления в водном растворе (реакция Е.Е. Вагнера, 1886): ОН ОН
[О] + НОН ½ ½
СН2=СН2 ¾¾¾® СН2-СН2
Глицерин СН2-СН2-СН2
ОН ОН ОН 1,2,3-пропантриол
В природе в свободном виде почти не встречается, но очень распространены и имеют большое биологическое и практическое значение его сложные эфиры с некоторыми высшими органическими кислотами – так называемые жиры и масла.
Используется в парфюмерии, фармации, в текстильной промышленности, в пищевой промышленности, для получения нитроглицерина и т.д. Это бесцветная горючая жидкость, без запаха, сладкая на вкус. (Следует сказать, что с увеличением числа групп ОН в молекуле сладость вещества увеличивается.) Очень гигроскопичен, смешивается с водой и спиртом. Ткип. 290 оС (с разложением), d204=1,26 г/см3. (Температуры кипения более высокие, чем у одноатомных спиртов – больше водородных связей. Это ведет к более высокой гигроксопичности и более высокой растворимости.)
Глицерин нельзя хранить с сильными окислителями: контакт с этими веществами приводит к возникновению пожара. (Например взаимодействие с KMnO4, Na2O2, CaOCl2 приводит к самовоспламенению.) Тушить рекомендуется водой и пеной.
Кислотность спиртовых групп в глицерине еще выше. В реакциях может участвовать одна, две или три группы. Глицерин также как и этиленгликоль растворяет Cu(OH)2, образуя интенсивно- синий раствор глицерата меди. Тем не менее, так же как одноатомные и двухатомные спирты, нейтрален на лакмус. Гидроксильные группы глицерина замещаются на галогены.
При действии водоотнимающих средств или при нагревании от глицерина отщепляется две молекулы воды (дегидратация). При этом образуется неустойчивый непредельный спирт с гидроксилом при углероде с двойной связью, который изомеризуется в непредельный альдегид акролеин (имеет раздражающий запах, как от дыма пригоревших жиров):
СН2-СН-СН2
½ ½ ½ ¾® СН2=С=СН-ОН ¾® СН2=СН-СНО
ОН ОН ОН -2Н2О промежуточный акролеин
непредельный спирт
При взаимодействии глицерина с азотной кислотой в присутствии Н2SO4 идет следующая реакция:
СН2-ОН НО-NO2 CH2-O-NO2
CH-OH + HO-NO2 ¾® CH-O-NO2 + 3H2O
½ H2SO4 ½ азотнокислый эфир гли-
CH2-OH HO-NO2 CH2-O-NO2 церина (нитроглицерин)
(глицеринтринитрат)
Нитроглицерин – тяжелое масло (d15= 1,601 г/см3), не растворяется в воде, но хорошо растворимое в спирте и других органических растворителях. При охлаждении кристаллизуется (Тпл.=13 оС), очень ядовит.
Нитроглицерин – сильное бризантное взрывчатое вещество. [Синтезировал это соединение Альфред Нобель. На производстве этого соединения он создал себе колоссальное состояние. Проценты от того капитала используются до сих пор в качестве премиального фонда Нобелевских премий]. При ударе и детонации он мгновенно разлагается с выделением огромного количества газов:
4С3Н5(ОNO2)3 ® 12СО2 + 6N2 + О2 + 10Н2О
Для обеспечения безопасности при проведении взрывных работ им пользуются в виде так называемого динамита – смеси, состоящей из 75 % нитроглицерина и 25 % инфузорной земли (горная порода из кремнистых оболочек диатомовых водорослей). 1 % спиртовый раствор нитроглицерина используется в качестве сосудорасширяющего средства, взрывчатыми свойствами не обладает.
В технике глицерин получают гидролизом (омылением) природных жиров и масел:
СН2-О-С =O СН2-ОН
СН-О-С =O + 3Н2О ® СН-ОН + 3R-C
СН2-О-С =O СН2-ОН
R глицерин кислота
Другой способ получения глицерина заключается в сбраживании глюкозы (полученной осахариванием крахмала) в присутствии, например, бисульфита натрия по схеме:
NaHSO3 CH2-CH-CH2
С6Н12О6 ¾¾® ½ ½ ½ + CH3-CН=О + CO2
OH OH OH уксусный альдегид
При этом С2Н5ОН почти не образует. В последнее время глицерин получают и синтетическим путем исходя из пропилена газов крекинга или пропилена, получаемого из природных газов. По одному из вариантов синтеза, пропилен хлорируют при высокой температуре (400-500 оС), полученный хлористый аллил путем гидролиза переводят в аллиловый спирт. На последний действуют перекисью водорода, которая в присутствии катализатора и при умеренном нагревании присоединяется к спирту по двойной связи с образованием глицерина:
СН3 CH2-Cl CH2-OH CH2-OH
½ +Cl2 ½ +NaOH ½ HO-OH ½
СН ¾® CH ¾® CH ¾¾® CH-OH
II -HCl II -NaCl II ½
CH2 CH2 CH2 CH2-OH
пропилен хлоритый аллиловый глицерин
аллил спирт
Простые эфиры
Простыми эфирами называют производные спиртов, образованные в результате замещения водорода гидроксильной группы спирта на углеводородный остаток. Эти соединения можно рассматривать и как производные воды, в молекуле которой углеводородными остатками замещены оба атома водорода:
R-O-H H-O-H R-O-R
спирт вода простой эфир
Как видно из приведенной общей формулы, в молекуле простого эфира два углеводородных остатка соединены через кислород (эфирный кислород). Эти остатки могут быть либо одинаковыми, либо различными; эфиры, в которых с кислородом соединены различные углеводородные остатки, называются смешанными простыми эфирами.
Номенклатура и изомерия
Радикально-функциональные названия наиболее употребительны. Их образуют из названий связанных с кислородом радикалов и слова "эфир" (функциональное название класса); названия различных радикалов перечисляют в порядке возрастания сложности (номенклатура ИЮПАК рекомендует и алфавитное перечисление радикалов).
СН3-О-СН3 СН3-СН2-О-СН2-СН3
диметиловый диэтиловый (или этиловый) эфир
(или метиловый) эфир
СН3-О-СН2-СН3 СН3-О-СН2-СН2-СН3 СН3-О-СН-СН3
метилэтиловый эфир метилпропиловый эфир ½
метилизопропиловый эфир СН3
Изомерия
Нетрудно заметить, что диэтиловый и метилпропиловый эфиры имеют одинаковый состав С4Н10О, т.е. это изомеры. В их молекулах радикалы, соединенные с кислородом, различаются составом. Эфирам присуща и обычна изомерия строения радикалов. Так, изомером метилпропилового эфира является метилизопропиловый эфир. Следует заметить, что простые эфиры изомерны одноатомным спиртам. Например, один и тот же состав С2Н6О имеют диметиловый эфир СН3-О-СН3 и этиловый спирт СН3-СН2 –ОН. А составу С4Н10О отвечают не только диэтиловый, метилпропиловый и метилизопропиловый эфиры, но и 4 бутиловых спирта состава С4Н9ОН.
Физические свойства
Диметиловый эфир кипит при -23,7 оС, метилэтиловый - при +10,8 оС. Следовательно в обычных условиях это газы. Диэтиловый эфир – уже жидкость (Ткип.= 35,6 оС). Низшие простые эфиры кипят ниже, чем спирты, из которых они получены, или чем изомерные им спирты. Например, диметиловый эфир, как уже показано – газ, тогда как метиловый спирт, из которого образуется этот эфир, - жидкость с Ткип.=64,7 оС, а изомерный диметиловому эфиру этиловый спирт – жидкость, с Ткип.=78,3 оС; это объясняется тем, что молекулы простых эфиров, не содержащие гидроксилов, в отличие от молекул спиртов не ассоциированы.
Простые эфиры мало растворимы в воде; в свою очередь вода в небольшом количестве растворяется в низших эфирах.
Химические свойства
Главной особенностью простых эфиров является их химическая инертность. В отличие от сложных эфиров они не гидролизуются и не разлагаются водой на исходные спирты. Безводные (абсолютные) эфиры в отличие от спиртов при обычных температурах не реагируют с металлическим натрием, т.к. в их молекулах нет активного водорода.
Расщепление простых эфиров происходит под действием некоторых кислот. Например, концентрированная (особенно дымящая) серная кислота поглощает пары простых эфиров, и при этом образуется сложный эфир серной кислоты (этилсерная кислота) и спирт. Например:
СН3-СН2 O-SO3H
O + ½ ® CH3-CH2-OSO3H + CH3-CH2-OH
диэтиловый эфир этилсерная кислота этиловый спирт
Иодистоводородная кислота также разлагает простые эфиры, в результате получаются галогеналкил и спирт:
СН3-СН2 Н
О + ½ ® СН3-СН2-I + СН3-СН2-ОН
СН3-СН2 I иодистый этил этиловый спирт
При нагревании металлический натрий расщепляет простые эфиры с образованием алкоголята и натрийорганического соединения:
О + 2Na ® CH3-CH2-ONa + CH3-CH2-Na
СН3-СН2 этилат натрия этилнатрий
Способы получения
Межмолекулярная дегидратация спиртов (см. стр. 95).
Взаимодействие алкоголятов с галогеналкилами. При этом выделяется соль галогенводородной кислоты и образуется простой эфир. Этот метод, предложенный Вильямсоном (1850), особенно удобен для получения смешанных простых эфиров. Например:
СН3-I + NaO-CH2-CH3 -
иодистый этилат натрия
метил ® СН3-O-CH2-CH3 + NaI
СН3-ОNa + I-CH2-CH3 - метилэтилэфир
метилат иодистый этил
Диэтиловый (этиловый) эфир. Имеет очень большое значение, его обычно называют просто эфиром. Получается главным образом дегидратацией этилового спирта при действии концентрированной H2SO4. Этим методом диэтиловый эфир был получен впервые еще в 1540г. В. Кордусом; долгое время диэтиловый эфир неправильно называли серным эфиром, т.к. предполагали, что он должен содержать серу. В настоящее время диэтиловый эфир получают пропуская пары этилового спирта над окисью алюминия Al2O3, нагретой до 240-260 оС.
Диэтиловый эфир – бесцветная легколетучая жидкость с характерным запахом. Ткип.=35,6 оС, Ткрист.= -117,6 оС, d204 = 0.714 г/см3, т.е. эфир легче воды. Если его встряхивать с водой, то затем при стоянии эфир "отслаивается" и всплывает на поверхности воды, образуя верхний слой. Однако, при этом некоторое количество эфира растворяется в воде (6,5 ч. в 100 ч. воды при 20 оС). В свою очередь при той же температуре в 100 ч. эфира растворяется 1,25 ч. воды. Со спиртом эфир смешивается очень хорошо.
Важно иметь в виду, что обращаться с эфиром надо очень осторожно; он очень горюч, а пары его с воздухом образуют взрывоопасные – гремучие смеси. Коме того, при длительном хранении, особенно на свету, эфир окисляется кислородом воздуха и в нем образуются так называемые перекисные соединения; последние от нагревания могут разлагаться со взрывом. Такие взрывы возможны при перегонке долго стоявшего эфира. СН3-СН2-О-СН2-СН3 + О2 ¾® СН3-СН-О-СН2-СН3
гидропероксид
О-ОН диэтилового эфира
Эфир очень хороший растворитель жиров, масел, смол и других органических веществ, и его широко используют для этой цели, часто в смеси со спиртом.
Тщательно очищенный эфир применяют в медицине в качестве средства общего наркоза при хирургических операциях.
Дипропиловый эфир С6Н14О. Ткип.90,7 оС. Легковоспламеняющаяся бесцветная жидкость. Растворимость в воде 0,25 % весовых при 25 оС, Твсп.= -16 оС, Тсамовоспл.=240 оС; минимальная Тсамовоспл.=154 оС; температурные пределы воспламенения: нижний -14 оС, верхний 18 оС.
Список литературы
Писаренко А.П., Хавин З.Я. Курс органической химии. М., Высшая школа, 1975. 510 с.
Нечаев А.П. Органическая химия. М., Высшая школа, 1976. 288 с.
Артеменко А.И. Органическая химия. М., Высшая школа, 2000. 536 с.
Березин Б.Д., Березин Д.Б. Курс современной органической химии. М., Высшая школа, 1999. 768 с.
Ким А.М. Органическая химия. Новосибирск, Сибирское университетское издательство, 2002. 972 с.
Предельные одноатомные спирты (алканолы) – органические соединения в молекулах которых алкильный радикал R связан с гидроксильной группой. Состав соответствует R-OH или CnH2n+1OH, с наличием функциональной (характеризующей свойства вещества) гидроксогруппы. Число гидроксогрупп определяет атомность соединения. Названия предельных одноатомных спиртов определяются по числу атомов и строению углеродной цепи. Характерная межклассовая изомерия и водородная связь т. е. связь между атомом водорода и атомом сильно электроотрицательного элемента.
Химические свойства
- Хорошо растворяются в воде.
- Горят.
- Взаимодействуют с металлическим натрием, образуя алкоголяты.
- Вступают в реакцию внутримолекулярной дегидратации, образуя этилен.
- Вступают в реакцию межмолекулярной дегидратации, образуя простые эфиры.
- Оксидом меди II окисляются в соответствующие альдегиды .
- Реагируют с карбоновыми кислотами, образуя сложные эфиры.
Виды
- Этиловый спирт (С6Н5ОН) – продукт реакции гидратации этилена, а также исходное вещество для лабораторного способа получения этилена реакцией гидратации. Получают его с помощью спиртового брожения.
- Этиленглиголь (НОСН2-СН2) – двухатомный спирт, образуется в результате окисления этилена с раствором перманганата калия.
- Метиловый спирт (метанол, СН3ОН) – начинает гомологический ряд предельный одноатомных спиртов. Бесцветная жидкость с характерным запахом, горит голубоватым пламенем, используется в фармацевтике, топливной промышленности, очень ядови.
- Этиловый спирт (этанол, С2Н5ОН) – второй по счёту элемент в гомологическом ряде предельных одноатомных спиртов. Бесцветная жидкость с характерным запахом, смешивается с водой в любом соотношении. Когда попадает в организм человека, то сначала вызывает состояние своеобразного опьянения, а затем приводит к обезвоживанию организма.
- Пропиновый спирт (пропанол, С3Н7ОН) – третий по счёту в гомологическом ряде предельных одноатомных спиртов. Точнее говоря, это место занимают два изомера: пропанол-1, пропанол-2. Пропанол-2 можно получить гидратацией пропена, которая протекает в соответствии с правилом Марковникова.
- Бутиловый спирт (бутанол, С4Н9ОН) – четвёртое место в гомологическом ряду предельных одноатомных спиртов занимают следующие изомеры: бутанол-1, бутанол-2, 2-метилпропанол-1, 2-метилпропалол-2.
- Глицерин – трёхатомный спирт, не ядовит, растворим в воде, за счёт поглощения влаги и воздуха увеличивается на 40%. Используется в парфюмерной, кондитерской, текстильной и гигиенической промышленности, при изготовлении пластмасс и взрывчатых веществ. Взаимодействуют с гидроксидом меди II c образованием ярко-синего раствора.
Предельные одноатомные спирты, или алкоголи
При замещении в углеводородах ряда метана одного атома водорода на одновалентный радикал гидроксил (водный остаток) ОН получаетсягомологический ряд одноатомных предельных спиртов, или алкоголей, имеющих следующую общую формулу:
Число изомеров, равно как и характер изомерии, для спиртов совершенно такие же, как и для моногалоидных производных углеводородов.
Номенклатура
Названия спиртов производятся от названий радикалов. Соответственно этому СН 3 —ОН называется метиловым спиртом, С 2 Н 5 —ОН — этиловым, С 3 Н 7 —ОН — пропиловыми, С 5 Н 11 —ОН—амиловыми спиртами и т. д.
Из двух изомерных алкоголей С 3 Н 7 —ОН спирт строения СН 3 —СН 2 —СН 2 —ОН есть первичный пропиловый, спирт СН 3 —СН(ОН)—СН 3 — вторичный пропиловый, или изопропиловый. Спирт С 4 Н 9 —-ОН строения (СН 3) 3 С—ОН представляет собой третичный бутиловый спирт.
Спирты первичные, вторичные и третичные можно рассматривать как происшедшие от метилового спирта, или карбинола, СН 3 —ОН замещением в егомолекуле одного, двух или трех атомов водорода на один, два или три углеводородных остатка, или алкила. Поэтому по старой рациональной номенклатуре спиртов их названия производились от «карбинола» с указанием на замещающие алкилы. Таким образом, этиловый спирт по этой номенклатуре называется метилкарбинолом, первичный пропиловый — этилкарбинолом, изопропиловый — диметилкарбинолом, третичный бутиловый — триметилкарбинолом.
Названия спиртов, имеющих разветвленное строение, производят от названий спиртов нормального строения, указывая положение боковой цепи греческой буквой: атом углерода, при котором находится гидроксил, отмечается буквой α, соседний с ним — буквой β, следующий — буквой γ и т. д. Таким образом, спирт
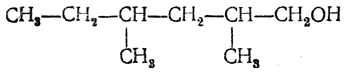
может быть назван β,δ-диметилгексиловым спиртом.
Женевская номенклатура производит названия спиртов от названий углеводородов с присоединением окончания ол и с приставкой в конце цифры, обозначающей тот атом углерода, при котором находится гидроксил. Таким образом возникают названия: для метилового спирта — метанол, для этилового — этанол, для первичного пропилового — пропанол- 1, для вторичного пропилового — пропанол- 2, для третичного бутилового — 2-метилпропанол- 2 и т. д.
1. Получение из галоидных алкилов
Наиболее общим способом является получение спиртов из галоидных соединений обменом атомат галоида на гидроксил:
Этим способом можно получать спирты первичные, вторичные и третичные в зависимости от строения радикала С n Н 2n +1
Иногда для получения спирта из галоидного алкила сначала получают сложный эфир уксусной кислоты взаимодействием галоидного алкила с уксуснокислым серебром, например
а затем омылением сложного эфира получают спирт:
Можно получать спирты, исходя из галоидных алкилов, окислением магнийорганических соединений. Промежуточно образуются перекисные соединения
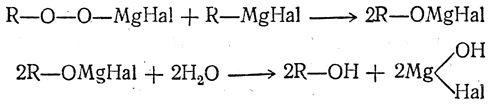
2. Присоединение элементов воды к этиленовым углеводородам (гидратация)
Например:
Реакция происходит при нагревании этиленовых углеводородов с водой или водяным паром в присутствии таких веществ, как минеральные кислоты (в первую очередь серная и фосфорная), окись алюминия, хлористый цинк и др. Эти вещества действуют как катализаторы, т. е. они оказываются в концереакции неизменными. Однако с серной кислотой образуется вполне определенный промежуточный продукт, называемый этил серной , или серновинной,кислотой:

Этилсерная кислота реагирует с водой, образуя спирт и серную кислоту:
Лишь сам этилен дает при этом первичный спирт. Гомологи этилена образуют вторичные или третичные спирты.
3. Действие азотистой кислоты на амины
Спирты можно получить действием азотистой кислоты на первичные амины, причем в зависимости от строения радикала получается первичный, вторичный или третичный спирт. Иногда наряду со спиртами получаются непредельные углеводороды в значительном или даже преобладающем количестве.
4. Восстановление альдегидов или органических кислот
При этом получаются первичные спирты, например:
Чаще восстанавливают не самые кислоты, а их хлорангидриды, ангидриды или сложные эфиры. Особенно часто применяется восстановление сложных эфиров, причем для получения водорода в момент выделения используют кипящий спирт и металлический натрий (Буво). В последнее время вместонатрия для этой цели широко применяется литийалюминийгидрид LiAlH 4 .
В технике большие количества первичных спиртов готовят восстановлением альдегидов, получаемых путем оксосинтеза.
5. Восстановлением кетонов получаются вторичные спирты , например:
6. Действие металлоорганических соединений на карбонилсодержащие соединения
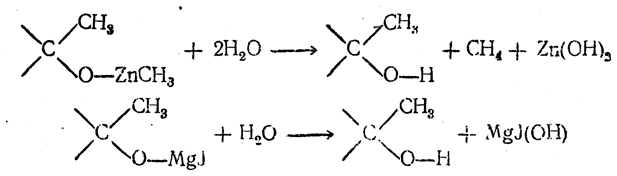
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Подбирая карбонилсодержащие вещества соответствующего строения, можно получать как первичные спирты, так и вторичные и третичные. Получение спиртов действием цинкдиалкилов на разные карбонилсодержащие соединения открыли и разработали А. М. Бутлеров и его ученики. Поэтому такие реакции называют их именами.
Эти реакции имели большое историческое значение. Именно таким путем А. М. Бутлеров впервые получил третичные спирты
строение которых он разъяснил на основании созданной им теории строения. Позднее Барбье, и особенно его ученик — Гриньяр, показали, что гораздо легче получать и удобнее использовать смешанные магнийорганические соединения (реакции Гриньяра ).
Общая схема реакций состоит в присоединении карбонильной группой >С=О молекулы металлоорганического соединения так, что радикал (алкил) присоединяется к атому углерода, а остальная часть молекулы металлоорганического соединения — к атому кислорода:

При разложении водой образовавшихся продуктов получаются спирты:
Карбонильная группа содержится в альдегидах, кетонах, кислотах и в различных производных кислот. Так как простейший альдегид — муравьиный, илиформальдегид, имеет строение
а в остальных альдегидах и в кетонах атомы водорода замещены на углеводородные радикалы (один — у альдегидов, два — у кетонов)

то вкачестве окончательного продукта приведенных выше реакций из муравьиного альдегида получаются первичные спирты (В. Е. Тищенко), изостальных альдегидов — вторичные спирты (реакция Е. Е. Вагнера), из кетонов — третичные спирты (реакция А. М. Зайцева).
Если взять сложные эфиры муравьиной иликакой-либо иной карбоновой кислоты

то действие на них металлоорганических соединений протекает в две фазы, из которых первая тождественна изображенной выше, например:

Во второй фазе происходит обмен остатка RO на алкил металлоорганического соединения:
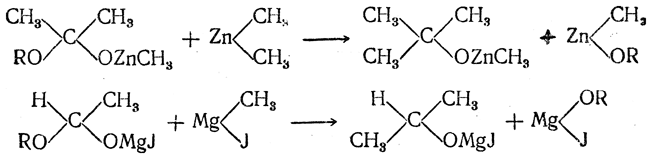
При разложении водой получающихся соединений в случае эфиров уксусной и высших кислот, а также при использовании в качестве исходных веществхлорангидридов этих кислот образуются третичные спирты (реакция А. М. Бутлерова). В случае эфиров муравьиной кислоты получается вторичный спирт(реакция А. М. Зайцева).
7. Синтез высших спиртов из низших
При нагревании спиртовых растворов алкоголятов щелочных металлов происходит синтез высших спиртов из низших. Так, например, из алкоголятапропилового спирта получается так называемый дипропиловый алкоголь. Реакция выражается уравнением:
Как показал В. В, Марковников, эта реакция происходит и при нагревании спиртов с твердым едким кали.
По-видимому, протеканием аналогичных реакций объясняется получение высших спиртов из смеси окиси углерода с водородом в присутствиикатализаторов — металлов группы железа. Первым продуктом здесь является метиловый спирт, изкоторого затем образуются высшие спирты:
Получающаяся таким образом смесь (синтол ) содержит, кроме большого количества предельных спиртов, также альдегиды, кетоны и кислоты, являющиеся, вероятно, продуктами дальнейшего превращения спиртов (Ф. Фишер). При определенных условиях из окиси углерода и водорода этим путем получают н -пропиловый и изобутиловый спирты.
Недавно предложен метод синтеза высших спиртов (С 8 ивыше) при помощи алюминийорганических соединений (К. Циглер):

Алюминийорганические соединения могут быть легко получены из олефинов вприсутствии водорода.
1. Образование алкоголятов Водородный атомгидроксильной группы при действии щелочных металлов способен заменяться на атомы этих металлов, причем получаются твердые, растворимые в спирте соединения, называемые алкоголятами:
Последняя реакция обратима.
Кроме алкоголятов щелочных металлов, известны также алкоголяты щелочноземельных металлов, алюминия и других металлов.
2-3. Действие галоидных соединений фосфора и действие кислот (этерификация) 2. Действие галоидных соединений фосфора. Эта реакцияприводит к получению галоидных алкилов.
3. Действие кислот (этерификация) При действии на спирты кислот происходит выделение воды и образуются вещества, называемые сложными эфирами:
Эта важная реакция, называемая реакцией этерификации, имеет внешнюю аналогию с реакцией нейтрализации кислоты щелочью (хотя сложные эфирыпо свойствам нисколько не напоминают соли).
Аналогично образованию кислых и средних солей при нейтрализации двухосновных кислот, при этерификации двухосновной, например серной, кислотывозможно образование кислого сложного эфира, называемого алкилсерной кислотой
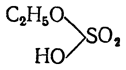
или же — среднего эфира

Сопоставляя реакцию этерификации с реакцией образования алкоголятов, можно видеть, что в спирте, как и в воде, очень слабые основные свойства сочетаются с еще более слабыми кислотными свойствами. В отличие от реакции нейтрализации, которая, как известно, представляет собой ионнуюреакцию, т. е. сводится к соединению ионов водорода и гидроксила, а потому идет моментально, реакция этерификации, как и громадное большинствореакций органических веществ, не является ионной реакцией и протекает медленно.
Реакции этерификации обратимы, а следовательно, ограничены состоянием равновесия. Реакции, обратные этерификации, состоящие в том, что сложный эфир, присоединяя воду, превращается в спирт и кислоту, называются реакциями омыления или гидролиза.
Этерификация спиртов органическими, а также слабыми минеральными кислотами идет очень медленно. Эта реакция ускоряется в присутствии сильных минеральных кислот, так как в растворах таких кислот создается высокая концентрация ионов водорода, являющихся катализаторами реакцииэтерификации. По этой же причине этерификация спиртов сильными минеральными кислотами идет быстро.
Как показали классические исследования Н. А. Меншуткина, скорость и предел этерификации (равновесная степень этерификации) для разных спиртовразличны. Они — наибольшие для первичных спиртов и наименьшие для третичных. Однако это правило не всегда соблюдается, апотому изучение скоростей и пределов этерификации дает лишь ограниченную возможность устанавливать, является ли спирт первичным, вторичным или третичным.
Исследования Н. А. Меншуткина представляли собой фундаментальные физико-химические исследования динамики химических процессов в областиорганических соединений. Они послужили отправным пунктом для многих последующих работ вэтом направлении.
Реакцииэтерификации являются типичными обратимыми превращениями например, для этерификации этилового спирта уксусной кислотой можно написать такое уравнение:
Дляобъяснения каталитического действия ионов водорода, поставляемых сильнымикислотами, предложена следующая схема:

Поэтой схеме кислород карбонильной группы карбоновой кислоты, захватывая протон (катион минеральной кислоты), дает начало карбоний-иону I, который присоединяет молекулу спирта и образует сложный промежуточный оксониевый комплекс II, способный обратимо распадаться с отщеплениемводы. иобразованием карбоний-иона сложного эфира III. Последний, регенерируя минеральную кислоту (катализатор), дает молекулу сложного эфира.
Пользуясь методом «меченых атомов», удалось показать, что при этерификации кислоты спиртом молекула выделяющейся при этом воды образуется изгидроксила кислоты и водорода спирта (как это и следует из приведенной вышесхемы), ане изгидроксила спирта и водорода карбоксильной группы.
При этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О 18 , был получен сложный эфир, содержавший в своем составе этот изотоп кислорода:
Аналогичное исследование процесса омыления сложных эфиров водой, содержащей тяжелый изотоп кислорода, показало, что омыление эфиров идет по схеме
а не по схеме
потому, что образовавшаяся при омылении кислота содержала О 18 , а соответствующий спирт его не содержал. Присутствие или отсутствие О 18 устанавливалось сжиганием образца вещества и анализом образующихся продуктов сгорания (СО 2 и Н 2 О) на присутствие тяжелого изотопа кислородаО 18 .
Как показывает приведенный пример, в настоящее время, пользуясь методом «меченых атомов», удается глубже проникнуть в механизм химических процессов. В качестве «меченых атомов» используют тяжелые изотопы водорода Н 2 , кислорода О 18 и т. п. или радиоактивные изотопы других элементов.
Как реакцию, аналогичную этерификации, можно рассматривать и действие на спирты галоидоводородных кислот, приводящее к образованию галоидных алкилов. Эта реакция идет легче всего с третичными спиртами.
4. Отнятие воды (дегидратация)
Реакции, идущие с отнятием воды, могут в конечном результате приводить к образованию или этиленовых углеводородов, или простых эфиров. В первом случае молекула воды выделяется из одной молекулы спирта (за исключением метилового)
во втором случае — из двух молекул спирта:
Образование этиленового углеводорода может происходить при нагревании спирта, чаще всего в присутствии катализаторов или водоотнимающих средств. Легче всего идет дегидратация третичных, затем вторичных и труднее всего — первичных спиртов. Третичные спирты иногда дегидратируются уже при простом нагревании, но чаще требуется применение добавок (серная, борная, щавелевая кислоты, иод, хлористый цинк, кислый сульфат натрия и др.). Для дегидратации вторичных и первичных спиртов нужна высокая температура (200 — 350° С) и гетерогенные катализаторы, например Аl 2 О 3 , ThO 2 .
Простые эфиры образуются при нагревании избытка спирта с серной кислотой, а также при пропускании паров спирта через нагретый безводный сульфат алюминия или безводные квасцы.
5. Окисление
Реакции окисления имеют большое значение для установления строения органических веществ, так как они протекают по-разному для первичных, вторичных и третичных спиртов.
Действие окислителей, как и во многих других случаях, направляется прежде всего на уже «окисленный», т. е. связанный с кислородом, атом углерода. При этом из первичных и вторичных спиртов получаются главным образом продукты, содержащие в молекуле столько же атомов углерода, сколько их было в исходном спирте. В случае первичных спиртов первыми продуктами окисления являются альдегиды
могущие при дальнейшем окислении переходить в кислоты:
Вторичные спирты при окислении дают кетоны:
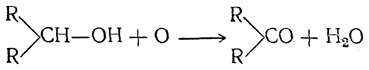
Окисление третичных спиртов, так же как и дальнейшее окисление кетонов и кислот, может происходить лишь с разрывом связей между атомамиуглерода, т. е. с расщеплением углеродного скелета. Обыкновенно и здесь окисление направляется, в первую очередь, на «окисленный» атом углерода и приводит к разрыву связей между ним и соединенными с ним радикалами.
6. Действие галоидов
Действие галоидов на первичные и вторичные спирты приводит прежде всего также к образованию альдегидов из первичных спиртов и кетонов из вторичных спиртов, например:
При дальнейшем действии галоидов происходит замещение на галоид атомов водорода в альдегидах и кетонах, 254).
7-8. Отщепление водорода. Превращение первичных и вторичных спиртов вальдегиды и кетоны может происходить и при пропускании паров спиртанад накаленными металлами — никелем, железом, цинком и пр., причем спирт распадается на альдегид (соответственно — кетон) и водород:
Особенно хорошо, и ктому же при более низких температурах, эта реакция идет с мелко раздробленной медью (Сабатье).
8. Действие магнийорганических соединений При действии на спирты магнийорганических соединений из радикала магнийорганического соединенияи водорода гидроксильной группы получается предельный углеводород. Вместо водорода гидроксильной группы вмолекулу спирта вступает остатокметаллоорганического соединения, например.
