Какими свойствами обладают спирты. Предельные одноатомные спирты, их строение, свойства. Применение и получение этилового спирта
Спиртами называются производные углеводородов, содержащие одну или несколько групп -ОН, называемую гидроксильной группой или гидроксилом.
Спирты классифицируют:
1. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами), трехатомные (с тремя гидроксилами) и многоатомные.
Подобно предельным углеводородам, одноатомные спирты образуют закономерно построенный ряд гомологов:
Как и в других гомологических рядах, каждый член ряда спиртов отличается по составу от предыдущего и последующего членов на гомологическую разность (-СН 2 -).
2.
В зависимости от того, при каком атоме
углерода находится гидроксил,
различают первичные, вторичные и
третичные спирты. В молекулах первичных
спиртов содержится группа -СН 2 ОН,
связанная с одним радикалом или с атомом
водорода у метанола (гидроксил при
первичном атоме углерода). Для вторичных
спиртов характерна группа >СНОН,
связанная с двумя радикалами (гидроксил
при вторичном атоме углерода). В молекулах
третичных спиртов имеется группа
>С-ОН, связанная с тремя радикалами
(гидроксил при третичном атоме углерода).
Обозначая радикал через R,
можно написать формулы этих спиртов
в общем виде:
В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется суффикс -ол. При наличии в соединении более старших функций гидроксильная группа обозначается префиксом гидрокси- (в русском языке часто используется префикс окси-). В качестве основной цепи выбирается наиболее длинная неразветвленная цепь углеродных атомов, в состав которой входит атом углерода, связанный с гидроксильной группой; если соединение является ненасыщенным, то в эту цепь включается также и кратная связь. Следует заметить, что при определении начала нумерации гидроксильная функция обычно имеет преимущество перед галогеном, двойной связью и алкилом, следовательно, нумерацию начинают с того конца цепи, ближе к которому расположена гидроксильная группа:

Простейшие спирты называют по радикалам, с которыми соединена гидроксильная группа: (СН 3) 2 СНОН - изопропиловый спирт, (СН 3) 3 СОН - трет-бутиловый спирт.
Часто употребляется рациональная номенклатура спиртов. Согласно этой номенклатуре, спирты рассматриваются как производные метилового спирта - карбинола:
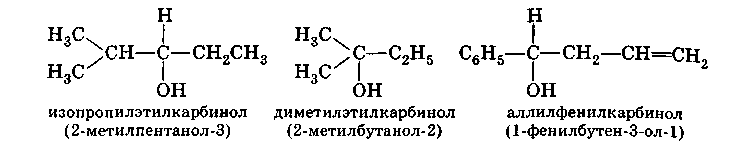
Эта система удобна в тех случаях, когда название радикала является простым и легко конструируемым.
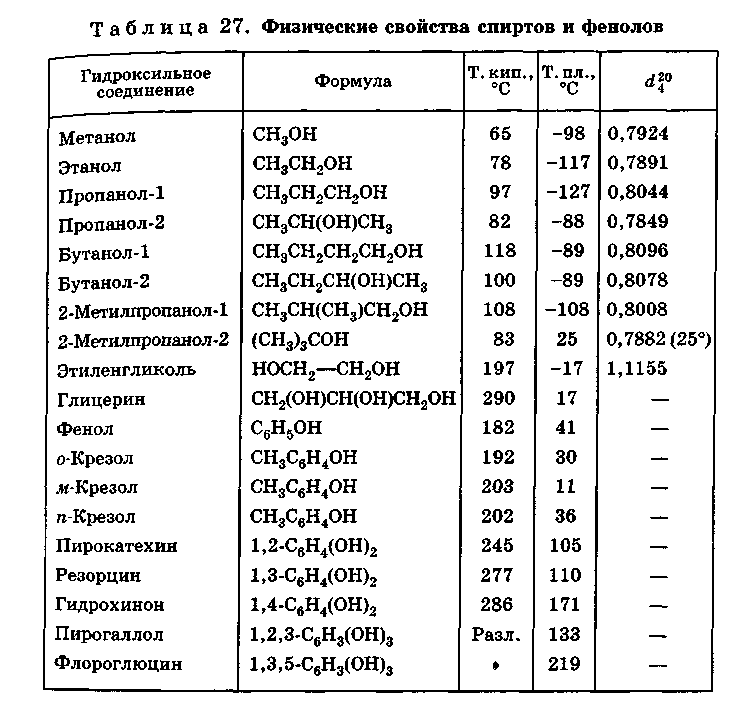
2. Физические свойства спиртов
Спирты имеют более высокие температуры кипения и значительно менее летучи, имеют более высокие температуры плавления и лучше растворимы в воде, чем соответствующие углеводороды; однако различие уменьшается с ростом молекулярной массы.
Разница в физических свойствах связана с высокой полярностью гидроксильной группы, которая приводит к ассоциации молекул спирта за счет водородной связи:
Таким образом, более высокие температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего требуется дополнительная энергия. С другой стороны, такого типа ассоциация приводит как бы к увеличению молекулярной массы, что естественно, обусловливает уменьшение летучести.
Спирты с низкой молекулярной массой хорошо растворимы в воде, это понятно, если учесть возможность образования водородных связей с молекулами воды (сама вода ассоциирована в очень большой степени). В метиловом спирте гидроксильная группа составляет почти половину массы молекулы; неудивительно поэтому, что метанол смешивается с водой во всех отношениях. По мере увеличения размера углеводородной цепи в спирте влияние гидроксильной группы на свойства спиртов уменьшается, соответственно понижается растворимость веществ в воде и увеличивается их растворимость в углеводородах. Физические свойства одноатомных спиртов с высокой молекулярной массой оказываются уже очень сходными со свойствами соответствующих углеводородов.
Вопрос 1. Предельные одноатомные спирты. Их строение, свойства, получение и применение.
Ответ. Одноатомные спирты – органические вещества, молекулы которых содержат одну гидроксильную групп, соединенную с углеводородным радикалом.
Гомология
Общая формула˸ C n H 2 n +1 OH, или R-OH.
Номенклатура
Названия спиртов производят от названий соответствующих углеводородов, прибавляя окончание ʼʼ-олʼʼ, или от названий радикалов с добавлением окончания ʼʼ-овыйʼʼ и слова ʼʼспиртʼʼ. Например˸
(этиловый спирт)
Нумеруют атомы углерода в структурной формуле спирта, начиная с того конца главной цепи, к которому ближе расположена OH – группа. Цифрой указывают атом углерода, при котором находится гидроксильная группа.
Изомерия
Спирты ˸ первичные R-OH, вторичные R 1 -CH(OH)-R 2 , третичные R 1 -C(OH)(R 2)-R 3 .
1. Изомерия углеродного скелета ˸
CH 3 -CH 2 -CH 2 -CH 2 OH,
бутанол-1
(первичный бутиловый спирт)
CH 3 -CH-CH 2 OH,
2- метилпропанол-1
(первичный изобутиловый спирт)
CH 3 -CH 2 -CH-CH 3
бутанол-2
(вторичный бутиловый спирт)
CH 3 - C - CH 3 .
2-метилпропанол-2
(третичный бутиловый спирт)
2. Изомерия положения гидроксильной группы ˸
CH 3 CH 2 CH 2 OH,
пропанол-1
CH 3 CH(OH)-CH 3 .
пропанол-2
3. Межклассовая изомерия ˸
диметиловый эфир
Спирты до С 12 – жидкости, начиная с С 13 – твердые вещества, низкие температуры кипения и плавления, растворимы в воде.
Химические свойства
Молекулы спиртов ассоциированы, поскольку между ними существуют водородные связи ˸
O-H‣‣‣ ‣‣‣ ‣‣‣O-H‣‣‣ ‣‣‣ ‣‣‣ O-H‣‣‣ ‣‣‣ ‣‣‣
1. Горение˸
2CH 3 OH + 3O 2 = 2CO 2 + 4H 2 O.
2. Взаимодействие с активными металлами ˸
2K + 2CH 3 OH = 2CH 3 OK + H 2 .
метилат калия
3. Взаимодействие с щелочами ˸
C 2 H 5 OH + NaOH = C 2 H 5 ONa + H 2 O.
4. Взаимодействие с галогеноводородами ˸
ROH + HBr = RBr + H 2 O.
5. Дегидратация ˸
а) при нагревании с водоотнимающим веществом ˸
C 2 H 5 OH CH 2 = CH 2 + H 2 O;
б) пропускание паров этанола над катализатором (по Лебедеву) ˸
2C 2 H 5 OH CH 2 = CH - CH = CH 2 + H 2 + 2H 2 O;
в) Получение простых эфиров ˸
C 2 H 5 OH + C 2 H 5 OH C 2 H 5 – O- C 2 H 5 + H 2 O.
6. Взаимодействие с оксидом меди ˸
C 2 H 5 OH + CuO Cu + CH 3 CHO + H 2 O.
(уксусный альдегид)
7. Этерификация ˸
С 2 H 5 OH + CH 3 COOH CH 3 COO – C 2 H 5 + H 2 O.
этилацетат
Спирты дают нейтральную реакцию, в их присутствии окраска лакмуса и фенолфталеина не изменяется.
Получение
1. Щелочной гидролиз˸
C 2 H 5 Cl + KOH = C 2 H 5 OH + KCl.
2. Гидротация алкенов ˸
CH 2 = CH 2 + H 2 O C 2 H 5 OH.
3. Восстановление альдегидов ˸
CH 3 CHO + H 2 = C 2 H 5 OH.
4. Брожение глюкозы ˸
C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2 .
5. Из оксида углерода (II) и водорода ˸
CO + 2H 2 CH 3 OH.
p метанол
(древесный спирт)
6. Гидролиз крахмала и клетчатки.
Применение
1.Как сырье в производстве многих органических соединений.
2.В производстве синтетического каучука и пластмасс.
Вопрос 1. Предельные одноатомные спирты. Их строение, свойства, получение и применение. - понятие и виды. Классификация и особенности категории "Вопрос 1. Предельные одноатомные спирты. Их строение, свойства, получение и применение." 2014, 2015-2016.
Предельные одноатомные спирты (алканолы) содержат одну гидроксильную группу –ОН, соединённую с насыщенным углеводородным радикалом. Общая формула алканолов: С n H 2 n +1 OH
Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ.
Гомологический ряд алканолов : CH 3 OH метанол, метиловый спирт
C 2 H 5 OH этанол, этиловый спирт
C 3 H 7 OH пропанол
C 4 H 9 OH бутанол
C 5 H 11 OH пентанол
Изомерия C 4 H 9 OH
CH 3 – CH 2 – CH 2 – CH 2 – OH бутанол-1
СН 3 -СН-СН 2 -ОН СН 3 -СН 2 -СН-СН 3
2-метилпропанол-1 2-бутанол
Физические свойства. Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С 12 Н 25 ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют спиртовой запах. Метанол – сильный яд. Все спирты ядовиты, обладают наркотическим действием.
Химические свойства
1. Растворы спиртов имеют нейтральную реакцию на индикаторы
2. Взаимодействие с щелочными металлами
2C 2 H 5 OH + 2Na → 2C 2 H 5 ONa + H 2
этанол этилат натрия
3. Взаимодействие с галогеноводородами
C 2 H 5 OH + HCl →C 2 H 5 Cl + H 2 O
хлорэтан
4. Дегидратация (при t и в присутствии H 2 SO 4)
C 2 H 5 OH → C 2 H 4 + H 2 O
2 C 2 H 5 OH→ C 2 H 5 –О- C 2 H 5
диэтиловый эфир
5. Горение
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O +Q
6. Окисление
C 2 H 5 OH + CuO → Cu + H 2 O + CH 3 -CHO
этанол уксусный альдегид
7. Взаимодействие с карбоновыми кислотами (реакция этерификации)
C 2 H 5 OH + CH 3 COOH → CH 3 COOC 2 H 5 + H 2 O
Получение этанола:
Этанол получают из
1) этилена: C 2 H 4 + HOH → C 2 H 5 OH (при катализаторе и t)
2) брожением глюкозы: C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2
Применение этанола : получение уксусной кислоты, лекарств, духов и одеколонов, каучуков, горючего для двигателей, красителей, лаков, растворителей и других веществ.
12. Глицерин – представитель многоатомных спиртов. Строение, физические и химические свойства (реакция этерификации), применение.
Глицерин – трёхатомный спирт:
Глицерин – бесцветная сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде, гигроскопичная. Глицерин получают расщеплением жиров.
Химические свойства.
1. Взаимодействие с щелочными металлами
СН 2 ОН CH 2 ONa
СНОН + 2Na → CHONa + H 2
СН 2 ОН CH 2 OH
2. Взаимодействие с галогеноводородами
СН 2 ОН CH 2 Cl
СНОН +3HCl → CH Cl + 3H 2 O
СН 2 ОН CH 2 Cl
3. Реакция этерификации (нитрование-взаимодействие с азотной кислотой)
4. Качественная реакция на многоатомный спирт
СН 2 ОН CH 2 O
СНОН + Cu(OH) 2 → CHO - Cu +H 2 O
СН 2 ОН CH 2 OH
Образуется синий раствор глицерата меди.
Применение глицерина – в медицине – для смягчения кожи и приготовлении мазей, в кожевенном производстве – для предохранения кож от высыхания, для получения пластмасс и взрывчатых веществ (нитроглицерин).
Спиртами называются производные углеводородов, содержащие одну или несколько групп -ОН, называемую гидроксильной группой или гидроксилом.
Спирты классифицируют:
1. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами), трехатомные (с тремя гидроксилами) и многоатомные.
Подобно предельным углеводородам, одноатомные спирты образуют закономерно построенный ряд гомологов:
Как и в других гомологических рядах, каждый член ряда спиртов отличается по составу от предыдущего и последующего членов на гомологическую разность (-СН 2 -).
2.
В зависимости от того, при каком атоме
углерода находится гидроксил,
различают первичные, вторичные и
третичные спирты. В молекулах первичных
спиртов содержится группа -СН 2 ОН,
связанная с одним радикалом или с атомом
водорода у метанола (гидроксил при
первичном атоме углерода). Для вторичных
спиртов характерна группа >СНОН,
связанная с двумя радикалами (гидроксил
при вторичном атоме углерода). В молекулах
третичных спиртов имеется группа
>С-ОН, связанная с тремя радикалами
(гидроксил при третичном атоме углерода).
Обозначая радикал через R,
можно написать формулы этих спиртов
в общем виде:
В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется суффикс -ол. При наличии в соединении более старших функций гидроксильная группа обозначается префиксом гидрокси- (в русском языке часто используется префикс окси-). В качестве основной цепи выбирается наиболее длинная неразветвленная цепь углеродных атомов, в состав которой входит атом углерода, связанный с гидроксильной группой; если соединение является ненасыщенным, то в эту цепь включается также и кратная связь. Следует заметить, что при определении начала нумерации гидроксильная функция обычно имеет преимущество перед галогеном, двойной связью и алкилом, следовательно, нумерацию начинают с того конца цепи, ближе к которому расположена гидроксильная группа:

Простейшие спирты называют по радикалам, с которыми соединена гидроксильная группа: (СН 3) 2 СНОН - изопропиловый спирт, (СН 3) 3 СОН - трет-бутиловый спирт.
Часто употребляется рациональная номенклатура спиртов. Согласно этой номенклатуре, спирты рассматриваются как производные метилового спирта - карбинола:
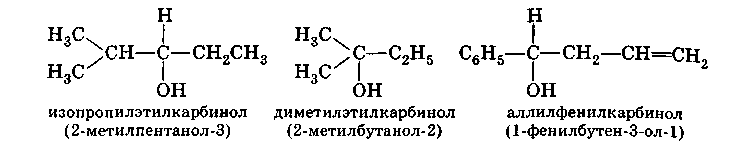
Эта система удобна в тех случаях, когда название радикала является простым и легко конструируемым.
2. Физические свойства спиртов
Спирты имеют более высокие температуры кипения и значительно менее летучи, имеют более высокие температуры плавления и лучше растворимы в воде, чем соответствующие углеводороды; однако различие уменьшается с ростом молекулярной массы.
Разница в физических свойствах связана с высокой полярностью гидроксильной группы, которая приводит к ассоциации молекул спирта за счет водородной связи:

Таким образом, более высокие температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего требуется дополнительная энергия. С другой стороны, такого типа ассоциация приводит как бы к увеличению молекулярной массы, что естественно, обусловливает уменьшение летучести.
Спирты с низкой молекулярной массой хорошо растворимы в воде, это понятно, если учесть возможность образования водородных связей с молекулами воды (сама вода ассоциирована в очень большой степени). В метиловом спирте гидроксильная группа составляет почти половину массы молекулы; неудивительно поэтому, что метанол смешивается с водой во всех отношениях. По мере увеличения размера углеводородной цепи в спирте влияние гидроксильной группы на свойства спиртов уменьшается, соответственно понижается растворимость веществ в воде и увеличивается их растворимость в углеводородах. Физические свойства одноатомных спиртов с высокой молекулярной массой оказываются уже очень сходными со свойствами соответствующих углеводородов.

