Проверочная работа по теме номенклатура органических соединений. Задачи и упражнения по органической химии
1 Задачи на использование общих формул гомологических рядов органических соединений :
Задача №1
Определите молярную массу (г\моль) алкана, содержащего 16 атомов водорода. Составьте структурную формулу. Назовите вещество
1 Запишем общую формулу гомологического ряда алканов: С n Н 2n+2
2 Запишем формулу алкана с 16 атомами водорода:
Он был заказан серией трактатов, относящихся к векам, самым известным из которых является Изумрудный стол. Из божества-хранителя науки тайная алхимия этого имени называлась герметиком. Вскоре это стало означать, что обучение недоступно, плотно закрыто для непосвященных. Следовательно, сегодня значение слова «воздухонепроницаемость» начинает означать нечто жесткое. Скажем, например, о герметичном закрытии банки.
Алхимия не была наукой в современном смысле этого слова, и это не может быть то, что многие делают, судя по ней, применяя современную меру. Алхимия была по существу философской и религиозной системой, используя вавилонскую астрологию, греческую философию, египетскую мифологию, гностицизм, а позже христианство, направленную на всестороннем понимании Вселенной, обучение Материи примы - в то же время, как высший принцип, регулирующем космос и человек.
Если водорода 16 атомов, то углерода соответственно 7.
3 Учитывая, что молярная масса – масса одного моля вещества – численно равна относительной молекулярной массе, а последняя равна сумме атомных масс элементов, входящих в вещество, с учетом индексов, запишем выражение для определения молярной массы заданного алкана с 16 атомами водорода.
В графических символах содержится семь металлов, которые относятся к семи известным планетам. Ответственность за боги греческой мифологии. Названия божеств называются днями недели на западноевропейских языках. Для алхимика смешивание двух металлов было не только технологическим процессом, но и объединением двух божеств. Две космические силы, связанные с планетами. Поэтому эта остановка должна была быть выполнена только с благоприятной планетной системой и с надлежащей духовной подготовкой. Она несла гностическое обещание духовной трансформации и спасения в жизни через знание высшей истины, которая называлась философским камнем.
М(С 7 Н 16)= 12*7+16*1=100г\моль
СН 3 – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 –СН 3
5 Назовем вещество: гептан.
Ответ: 100 г/моль.
Задача №2
Молекулярная масса алкина равна 54 .Определите, сколько атомов водорода он содержит? Составьте структурную формулу. Назовите вещество.
1 Запишем общую формулу гомологического ряда алкинов: С n Н 2n-2
Предполагалось, что философский камень будет получен путем химической трансформации. Предполагалось, что это вещество, которое сделало все возможное: больной был здоровым - его называли панацеей или болезнью для всех болезней; недрагоценные металлы благородные. Алхимические операции, такие как дистилляция или сублимация, имели глубокое символическое значение. Их работа была в первую очередь направлена на то, чтобы не получить подготовку, а духовное участие в продолжающейся трансформации. Он написал 28-томную работу, содержащую описания всех известных алхимических процессов того времени.
2 Учитывая, что молярная масса – масса одного моля вещества – численно равна относительной молекулярной массе, а последняя равна сумме атомных масс элементов, входящих в вещество, с учетом индексов, запишем выражение для определения молярной массы заданного алкина,зная что она равна 54.
М=12*n+1*(2n -2);
54=12*n+1*(2n -2);
3 Найдем n:
Вот что Зосимос пишет о работе алхимика в гностических писаниях. Демон Офиуш, который скрывается повсюду, мешает нашим исследованиям, принося нам небрежность и страх или непредвиденные несчастные случаи, а иногда и страдания и наказания, побуждающие нас отказаться от работы.
Еще одна линия алхимии, которую можно назвать практичной, представляет собой работу Анаксилауса Ларисы, которая сохранилась в виде фрагментов в двух экземплярах в настоящее время в Стокгольме и Лейдене. В упомянутых рукописях содержится коллекция рецептов для окраски, изготовления металлических сплавов и имитации драгоценных камней.
3 Найдем число атомов водорода в молекуле, если n=4.
Атомов водорода соответственно 6.
4 Составим структурную формулу:
СН≡С - СН 2 – СН 3
5 Назовем вещество:
Бутин – 1 .
2 Задания с использованием номенклатуры органических соединений, составлением формул изомеров органических веществ.
Задание №3 Напишите структурные формулы всех изомеров, которые могут соответствовать эмпирической формуле С 5 Н 10 ? Назовите вещества по международной номенклатуре.
Авторы тех времен часто ссылаются на авторитет половины легендарных мастеров, которые должны были быть обладателями тайны философского камня. Это объясняется автором знаменитой алхимической максимы. «Природа радуется природе, природе над природой, природе над природой».
В книге Пао Пу Идзу он описал алхимические преобразования, благодаря которым можно было получить средство вечной молодости и бессмертия и приобрести сверхъестественные способности. Тот, кто выиграл это лекарство, мог пройти через огонь, ходить по воде, командовать духами и демонами. Экспериментальная алхимия не развивалась в Китае так же, как на Западе. Известно, что китайцы смогли получить ряд соединений и химических элементов, таких как мышьяк, квасцы, киноварь, золото, свинец, серебро, цинк, медь, железо.
Изомерами называются вещества, имеющие одинаковый качественный и количественный состав, но различное строение и свойства.
Вещество, имеющее формулу С 5 Н 10 , относится к классу непредельных углеводородов, содержащих одну двойную связь.
Для него будет характерна:
1 Изомерия углеродного скелета;
2 Изомерия положения двойной связи.
В китайских алхимических работах мы находим подобные взгляды тем, которые известны в египетской алхимии. Трудно сказать, пришли ли алхимические идеи из Китая в Египет, или наоборот. Однако большинство ученых указывают на то, что Египет является источником алхимических знаний.
Они также переняли алхимические традиции. С точки зрения теории они создали новую концепцию ртути и серы, разработали концепцию эликсира жизни, известную из китайской алхимии, и создали концепцию философского камня. В области практической алхимии они значительно улучшили, в частности, лабораторные операции, такие как дистилляция, сублимация и кристаллизация. Перечислите здесь: спирт, щелочь, цирконий или азот. Самым известным алхимиком тех дней был Джабир ибн Хаджан, известный в Европе как Гебер.
Для написания формул изомеров углеродного скелета пишут вещество нормального строения, а затем укорачивают цепь на одну группу СН 3 и производя все возможные перестановки СН 3 -группы.
Для написания формул изомеров положения кратной связи, необходимо перемещать кратную связь.
Для того, чтобы назвать углеводороды используется номенклатура ИЮПАК.
Известный польский алхимик Михал Сёдзивой утверждал, что он философ. По этой причине жадные немецкие князья были заключены в тюрьму немцами, которые хотели добыть золотую тайну у мучителей. Для этого в Польше пожилой человек был принят с должной честью. Опираясь на учения, проповедованные в древности великим философом Аристотелем, многие ученые, называемые алхимиками, стремились найти способ превращения обычных металлов, таких как медь или железо, в благородное серебро или золото. В то время широко считалось, что существует таинственная субстанция, благодаря которой различные металлы могут быть превращены в золото.
Номенклатура углеводов.
Так как углеводородов очень много, то для них международным союзом теоретической и прикладной химии принята специальная номенклатура ИЮПАК. Название углеводорода дается в определенной последовательности.
1)Выбираем наиболее длинную цепь атомов углерода в молекуле.
CH3-CH-CH 2 -CH 2 -CH-CH 2 -CH 3
CH 2 CH 2 -CH 2 -CH 3
Это вещество называется философским камнем. Многие из алхимиков того времени были просто мошенниками. Используя хитроумные трюки, такие как двойное дно в посуде, растворение золота в ртути и другие способы, притворяются, что знают тайну философского камня и могут преобразовать металл. Мошенники вы организовали отсев «заменить металл» и доверчивые любители алхимии обманутых обещаний предательства тайны Философского Камня и получать большие количества золота, таким образом, получили значительные богатства часто.
Это было потому, что практика алхимиков вызывала большую озабоченность у князей, а не у царей. Однако в случае тюремного заключения алхимика о мошенничестве он был приговорен к виселице и, как он заказывал обычай, к позолоченной виселице. В конце концов, наряду с обманами алхимии, было много алхимиков, которых можно было назвать настоящими учеными. Они также искали способ превратить металлы, но, управляя их работой систематически, они делали многочисленные и важные открытия.
2)Нумеруем эту углеродную цепь, начиная с того конца, ближе к которому находятся разветвления
CH 3 -CH-CH 2 -CH 3
Если заместители находятся на равных расстояниях от конца цепи, то нумерацию начинают с более разветвленного конца.
CH 3 6 5 4 3 2 1
4 3 | 2 1 CH 3 -CH-CH 2 -CH-CH-CH 3
CH 3 -CH- C- CH 3 | | |
| | CH 3 CH 3 CH 3
Если и разветвленность главной цепи одинакова, то нумерацию начинают с того конца, ближе к которому находится радикал, название которого стоит раньше в алфавитном порядке.
Такой ученый был всемирно известным польским алхимиком Михалом Сёдзивой. Он разработал методы получения многочисленных кислот, металлов и солей и предоставил способы очистки соединений и их распознавания. Книга, в которой он описал свои выводы и опыт, был в то время лучшим и наиболее востребованным учебником. Поэтому неудивительно, что он достиг 30 выпусков на разных языках. Он знал Испанию, Англию, Францию, Германию, Швецию и даже Турцию. В этих странах к ним относились с большим уважением как самые выдающиеся ученые, так и правители.
Как и большинство алхимиков, он утверждал, что был философом. По этой причине он несколько раз был заключен в тюрьму разными немецкими князьями, которые хотели извлечь тайну философского камня от мучителей. Уже после короткого пребывания в Кракове он оказывает большое влияние на короля, который является энтузиастом алхимии, с которым он экспериментировал вместе. В Вавельском замке посетители все еще могут видеть камеры, где проводились эксперименты. Сцена, изображающая эксперименты Садовода, была представлена великим художником Яном Матекой.
CH 3 -CH 2 -CH 2 -CH-CH-CH 2 -CH 2 -CH 3
C 3 H 7 С 2 H 5
пропил этил
3) а)основу названия определяет углеводород, содержащий столько же атомов, сколько их содержится в пронумерованной цепи, например: 4 атома-бутан, 9 атомов-нонан и т.д.
б)в названии вещества цифрой указывают, при каком атоме углерода находится радикал.
в) если замещающих групп несколько, цифрами отмечают каждую из них.
Работы, оставленные польским алхимиком, были написаны таким образом, что только посвященный мог их понять. Как и все писания, они содержат много философских и естественных соображений. К концу своей жизни Саддам поселился в Чехии, где прославился как строитель рудников и металлургических предприятий.
Один из самых известных алхимиков родился в Пантуасе в течение года. Были копиры и иллюстраторы, которым часто помогал сам Фламель. Пернелле было другое преимущество, что многие женщины могли только позавидовать ей, она была в состоянии хранить в секрете, чем позже Николас был очень важен.
г)если боковые радикалы одинаковы, то перечисляют цифры, указывающие их положение, а число этих радикалов указывают приставками ди-(два), три-(три), тетра-(четыре), пента-(пять) и т. д. Радикалы, если они различны перечисляют в алфавитном порядке.
Например: CH 3
CH 3 -CH-CH 2 -CH 3 CH 3 -C-CH 3
2-метилбутан 2,2-диметилпропан
CH 3 -CH-CH 2 -CH-CH 2 -CH 3
Не известно точно, когда Фламель заинтересовалась алхимия, но известно, что он был одним из первых алхимиков в Европе, интерес к алхимии практики египтян и греков в меньшей степени, арабы, не погружается в практику в то время как евреи, которые впоследствии оказались так ему нужно. Во всяком случае, он уже с самого начала знал, что путь к всеведению, ключ к пониманию механизмов мира скрывается в книге, но даже в самых смелых мечтах представить себе, что книга войдет в его руку таким образом, в котором это произошло.
Однажды ночью во сне ангел предстал перед ним в книге и сказал: «Позаботьтесь о этой книге хорошо, хотя в начале, как и другие, вы не поймете этого, но будет так, что вы увидите то, что никто другой не видел». Николай проснулся и ничего особенного не получал, никаких книг, откуда или чего-либо на вкус. Можно сделать вывод, что это не видение и просто мечта, и, наконец, Фламель мечтал об этой книге, поэтому неудивительно, что он мечтал. Но через несколько дней бедный человек пришел в библиотеку, чтобы спасти его положение и хотел продать старую книгу, Николас собирался вымыть ее, но внезапно он увидел, что книга, как вы могли догадаться, была книгой, которая удерживала ангела от сна.
CH 3 C 2 H 5 2-метил- 4- этилгексан
Если вещество содержит кратные связи, то нумерацию начинают с того конца, ближе к которому находится кратная связь.
Если вещество содержит функциональные группы(-ОН, - С(О)Н, -СООН), то нумерацию начинают с того конца, ближе к которому находится функциональная группа.
Для веществ, содержащих кратные связи или некоторые функциональные группы, цифрой в конце указывают номер атома, у которого находится кратная связь или функциональная группа.
После этого наблюдения бухгалтер сразу же купил книгу и стал смотреть на нее. Фламель не учился. Его единственным решением было найти еврея, который научил бы ему этот язык или даже перевел книгу. К сожалению, в то время все сторонники иудаизма были изгнаны из Франции, поэтому дело стало усложняться.
Но алхимик не скопировал страницы книги и отправился в Испанию, где было много евреев, изгнанных из Франции. Ему повезло, что прежде всего его пути было небогато, но в конце концов, кто напал на ходунок скромно одетый с деревянной тростью и почти без денег. Фламел, когда ему было 21 год.
Для различных классов органических веществ существуют различные окончания:
Алканы - ан;
Алкены -ен;
Алкадиены - диен;
Алкины -ин;
Спирты -ол;
Альдегиды - аль;
Кетоны - он;
Карбоновые кислоты - -овая кислота.
Для веществ, содержащих группу - NО 2 к названию добавляют приставку нитро-; для аминокислот приставку амино-.
После долгих и бесплодных поисков Фламель решил вернуться во Францию, домой и любящей жене. Но когда он снова вернулся в таверну, он сидел за тем же столом, что и французский бизнесмен, путешествующий по делам. Еврей сказал, что он знает, что он будет с удовольствием перевести рукописи алхимика Фламель решил не увольнять шанс и на следующий день отправился с торговцем. Старый еврей не только перевел часть книги Авраама, и сказал, что он был Авраам сам, но решил пойти с Фламеля в Париж и расшифровать книгу.
К сожалению, по пути, несмотря на усилия алхимика, его возраст был известен ему, он умер, был отправлен на христианские похороны, потому что они были уже во Франции, а Николай встретил ужасное наказание, если он сообщил, что он ввел иудаизма в государство. Но эти пары переведенных страниц и то, что сказал ему старик, было достаточно, чтобы получить знания, необходимые для расшифровки книги.
Соответственно составим формулы изомеров и назовем их:
а) СН 2 =С – СН 2 – СН 3
СН 3 2-метилбутен-1
б) СН 3 - С =СН – СН 3
СН 3 2-метилбутен-2
в) СН 2 =С Н– СН – СН 3
СН 3 3-метилбутен-1
г) СН 2 =СН – СН 2 - СН 2 – СН 3
д) СН 3 - СН =СН - СН 2 – СН 3
3 Задания с использованием электронных представлений в органической химии.
Задание № 4. Объясните на основе электронной теории почему фенол имеет более высокие кислотные свойства, чем спирты.
Для решения заданий такого типа необходимо использовать одно из положений теории А.М. Бутлерова: Атомы и группы атомов взаимно влияют друг на друга.
Проанализировав значения электроотрицательностей элементов, определяют куда смещаются электронные плотности связей в молекуле и как в связи с этим меняются свойства.
В феноле(С 6 Н 5 ОН) связь кислорода с водородом ослаблена, так как шестиэлектронное p-облако бензольного ядра взаимодействует с парой р-электронов атомов кислорода ОН-группы, как бы втягивая в свою систему, вследствие чего электронная плотность связи О-Н в большей степени смещается к кислороду. Водород становится более подвижным и может отщепляться в виде протона. Так как в спиртах отсутствует бензольное ядро, такого смещения плотностей не происходит и они обладают менее выраженными кислотными свойствами.
4 Задания с использованием знаний о физических свойствах и качественных реакциях органических веществ .
Многие органические вещества имеют специфические физические свойства. Для обнаружения органических веществ в растворах используют знания о их физических свойствах и качественных реакциях.(качественные реакции органических соединений см. таблицу №1.)
Задание № 5.
Какими способами можно распознать бутен, бутанол, бутановую кислоту? Составьте план решения, опишите наблюдения, составьте уравнения реакций.
Составим план решения:
1 Определим функциональные группы.
2 Рассмотрим качественные реакции.
1 Рассмотрим функциональные особенности веществ:
а) бутен СН 2 =СН – СН 2 – СН 3 относится к ненасыщенным углеводородам, содержащим двойную связь.
б) бутанол СН 3 - СН 2 – СН 2 – СН 2 ОН относится к насыщенным одноатомным спиртам.
в) бутановая кислота СН 3 - СН 2 – СН 2 – СООН относится к насыщенным одноатомным кислотам, содержит карбоксильную группу.
2 Рассмотрим качественные реакции:
а) Качественной реакцией на алкены является пропускание их через бромную воду или раствор перманганата калия.
б) Качественной реакцией на насыщенные одноатомные спирты является взаимодействие с металлическим натрием.
в) Качественной реакцией на карбоновые кислоты является изменение окраски индикатора в их среде и взаимодействие их со спиртами.
3 Опишем наблюдения и составим уравнения реакций.
а) При пропускании бутена через бромную воду происходит обесцвечивание раствора.
СН 2 =СН – СН 2 – СН 3 + Br 2 = СН 2 - СН – СН 2 – СН 3
СН 2 =СН – СН 2 – СН 3 + 2 [O]= СН 2 - СН – СН 2 – СН 3
б) При действии на спирты металлического натрия наблюдается выделение газа и образование студенистой массой алкоголята.
2СН 3 - СН 2 – СН 2 – СН 2 ОН +2 Na=2 СН 3 - СН 2 – СН 2 – СН 2 О Na + Н 2
в) При добавлении к раствору бутановой кислоты индикатора лакмуса или метилового оранжевого наблюдается красное окрашивание.
При нагревании кислоты со спиртом в присутствии концентрированной серной кислоты появляется «эфирный запах» и образование слоя эфира, не смешивающегося с водой.
СН 3 - СН 2 – СН 2 – СООН + С 2 Н 5 ОН = СН 3 - СН 2 – СН 2 – СОО С 2 Н 5 + Н 2 О
4 Задания на вывод формул органических веществ.
Задание № 6
Органическое вещество содержит углерод(массовая доля 84,21%) и водород (15,79%).Плотность паров вещества по воздуху составляет 3,93. Определите формулу этого вещества.
W(С)= 84,21%.| 1 Пусть масса вещества 100г.
W(Н)= 15,79%.| 2 Тогда m(С)=84,21г, m(Н)=15,79г.
D(возд) = 3,93. | 3 Найдем соотношение количеств веществ:
_____________|_υ(С): υ(Н)=84,21\12:15,79/1=7,0175:15,79=1:2,25=4:9.
С x Н y С 4 Н 9 - простейшая формула.
Найдем молярную массу простейшей формулы:
М(С 4 Н 9)=57г\моль.
Найдем молярную массу истиной формулы:
М ист =3,93*29=114г\моль.
Найдем соотношение истиной и простейшей молярных масс:
Ми = 114 = 2.
С 8 Н 18 – истинная формула.
5 Расчетные задачи по уравнениям реакций.
Все расчетные задачи по уравнениям реакций можно разбить на несколько типов.
1) По условию задачи дана масса одного исходного вещества, требуется определить массу полученного продукта, если выход продукта реакции менее 100%.
Сколько граммов пропанола-2 с выходом 80% от теоретически возможного получится из 200г пропилена.
m(С 3 Н 6)= 200г.| 1 Составим уравнение реакции получения пропанола-2.
W(С 3 Н 7 ОН)= | СН 2 =СН – СН 3 + Н 2 О= СН 3 – СН – СН 3
____________ | ОН
m(С 3 Н 7 ОН)=? 2 Найдем количество вещества пропена, вступившего в реакцию:
υ(С 3 Н 6)= m\М
υ(С 3 Н 6)= 200\42=4,76моль.
3 Найдем по уравнению, что количество вещества пропанола -2 равно количеству вещества пропена, вступившего в реакцию:
υ(С 3 Н 7 ОН)=4,76 моль.
4 Найдем массу теоретическую образовавшегося пропанола-2
m = 4,76*60=285,7г
5 Учитывая, что выход вещества составляет 80%, найдем массу практическую продукта.
m пр = m теор * W\100%
m пр= 285,7*80\100=228,6г.
ответ: 228,6г.
2) По условию задачи дана масса исходных веществ. Требуется найти объем выделившегося газообразного продукта.(при нормальных условиях).
Какой объем (при нормальных условиях) займет метан, образовавшийся из 100г ацетата натрия.
m (СН 3 СОО Na )= 100г.| 1 Составим уравнение реакции получения метана:
CH 3 COONa+NaOH=CH4+Na 2 CO 3
2 Найдем количество вещества ацетата натрия, вступившего в реакцию:
υ(CH 3 COONa)= m\М
υ(CH 3 COONa)= 100\82=1,22моль.
3 Найдем по уравнению, что количество вещества метана равно количеству вещества ацетата натрия, вступившего в реакцию.
υ(CH 4)=1,22моль.
4 Найдем объем метана, образовавшегося в результате реакции:
V m =22,4 л\моль.
V=22,4*1,22=27,3л
Ответ 22,4л.
3) По условию дана масса исходного вещества, которое содержит примеси. Требуется определить массу(объем) полученного продукта.
Задача. Сколько литров (н.у.) образуется из 50г 60% -ного карбида кальция.
m(СаС 2)= 50г |1 Составим уравнение реакции получения ацетилена:
W(СаС 2 )=60% |
VC 2 H 2 =? 2 Найдем массу чистого карбида кальция:
m(СаС 2)=50*60\100=30г.
3 Найдем количество вещества карбида кальция, вступившего в реакцию:
υ(СаС 2)= m\М
υ(СаС 2)=30\64=0,47 моль.
4 Найдем по уравнению, что количество вещества ацетилена равно количеству вещества карбида кальция, вступившего в реакцию:
υ(С 2 Н 2)=0,47 моль.
5 Найдем объем ацетилена, образовавшегося в результате реакции:
V m =22,4 л\моль.
V=22,4* 0,47=10,5л.
Ответ: 10,5л.
4) По условию задачи дана масса исходных веществ и полученных продуктов. Требуется определить выход продукта реакции в процентах.
Задача. Определить выход эфира в процентах от теоретически возможного, если из 300г уксусной кислоты и соответствующего количества спирта получено 400г этилацетата.
m(СН 3 СООН)=300г |1 Составим уравнение реакции
m (СН 3 СООС 2 Н 5 )= 400г.
W (СН 3 СООС 2 Н 5)= ? |2 Найдем количество вещества уксусной кислоты, вступившей в реакцию:
υ(СН 3 СООН)= m\М
υ(СН 3 СООН)=300\60=5 моль.
3 Найдем по уравнению, что количество вещества этилацетата равно количеству вещества уксусной кислоты, вступившей в реакцию:
υ(СН 3 СООС 2 Н 5)=5моль.
4 Найдем теоретическую массу образовавшегося этилацетата
m(СН 3 СООС 2 Н 5)=5*88=440г
5 Учитывая, что масса практическая этилацетата 400г, найдем массовую долю выхода продукта:
W= m пр \ m теор *100% ;
W=400\440*100=90%.
5) По условию задачи дана масса исходного вещества и масса продукта. Требуется определить процентное содержание примесей в исходном веществе.
Задача. Определить содержание примесей (в процентах)в карбиде кальция, если из 170г карбида кальция получено 50г ацетилена.
m(СаС 2)= 170г |1 Составим уравнение реакции получения ацетилена:
m (C 2 H 2 )= 50г | СаС 2 +2Н 2 О=С 2 Н 2 +Са(ОН) 2
W(прим)= ? 2 Найдем количество вещества ацетилена, образовавшегося в результате реакции:
υ(С 2 Н 2)= m\М
υ(С 2 Н 2)=50\26=1,92моль.
3 Найдем по уравнению, что количество вещества карбида кальция равно количеству вещества ацетилена, образовавшегося в результате реакции:
υ(СаС 2)= 1,92моль.
4 Найдем массу чистого карбида кальция:
m (СаС 2)=1,92*64=123г
5 Найдем массу примесей:
m (прим) = m (загряз. в-ва) - m (чист. в-ва)
m (прим) =170-123=47г
6 Найдем массовую примесей в карбиде:
W(прим)= m (прим) \ m (загряз. в-ва) *100%
W(прим)= 47\170*100=27,6%
Ответ: 27,6%
6) По условию задачи дана масса полученного продукта. Требуется определить необходимое количество исходных веществ, если выход продукта реакции менее 100%.
Задача. Сколько граммов этилового спирта нужно взять для получения 200г диэтилового эфира, если выход продукта равен 80% от теоретически возможного.
m (С 2 Н 5 ОС 2 Н 5) =200г|1 Составим уравнение реакции
W=80% | С 2 Н 5 ОН+ С 2 Н 5 ОН= С 2 Н 5 ОС 2 Н 5 +Н 2 О
m (С 2 Н 5 ОН)= ? 2 Найдем теоретическую массу образовавшегося продукта:
m теор = m пр * 100%\ W
m теор =200*100\80=250г.
3 Найдем количество вещества диэтилового эфира, образовавшегося в результате реакции: υ(С 2 Н 5 ОС 2 Н 5)= m\М
υ(С 2 Н 5 ОС 2 Н 5)=250\74=3,38моль.
4 Найдем по уравнению, что количество вещества этанола в 2 раза больше количеств вещества диэтилового эфира, вступившего в реакцию.
υ(С 2 Н 5 ОН)=3,38*2=6,76моль.
5 Найдем массу этанола, вступившего в реакцию:
m =6,76*46=310,8г
Ответ: 310,8г
7) По условию задачи дана масса полученного продукта. Необходимо найти необходимое количество растворов исходных веществ.
Задача. Сколько грамм 8% раствора уксусной кислоты необходимо для получения водорода объемом 2,8л при взаимодействии ее с магнием.
V(Н 2)=2,8л | 1Составим уравнение реакции
W(СН 3 СООН)=8% | 2 СН 3 СООН+Мg= (СН 3 СОО) 2 Мg +Н 2
m (р-ра) = ? 2 Найдем количество вещества водорода, образовавшегося в результате реакции: υ = V \V m ;
V m =22,4 л\моль
υ =2,8\22,4=0,125моль.
3 Найдем по уравнению, что количество вещества водорода в 2 раза меньше количеств вещества уксусной кислоты, вступившей в реакцию:
υ (СН 3 СООН)= 0,125*2=0,25моль.
4 Найдем массу уксусной кислоты:
m = 0,25*60=15г
5 Найдем массу раствора уксусной кислоты:
W= m в-ва \ m р-ра *100%
m р-ра = m в-ва * 100\ W.
m р-ра = 15*100\8=187,5г
Ответ: 187,5г
8)По условию задачи даны массы двух исходных веществ, одно из которых взято в избытке.
Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола.
m(СН 3 СООН)=100г|1 Составим уравнение реакции
m (С 2 Н 5 ОН)= 50г. | СН 3 СООН+ С 2 Н 5 ОН= СН 3 СООС 2 Н 5 +Н 2 О
m (СН 3 СООС 2 Н 5)= ?|2 Найдем количество веществ уксусной кислоты и этанола, вступившей в реакцию:
υ(СН 3 СООН)= 100\60=1,67моль.
υ(С 2 Н 5 ОН)= 50\46=1,09 моль.
3 Так как по уравнению реакции уксусная кислота и этанол реагирует 1:1, то из найденных значений видно, что в избытке находится уксусная кислота и часть ее останется после реакции, а этанол прореагирует полностью. Решаем по недостатку.
4 Найдем по уравнению, что количество вещества этанола равно количеству вещества этилацетата, образовавшегося в результате реакции:
υ(СН 3 СООС 2 Н 5)=1,09моль.
5 Найдем массу этилацетата:
m = 1,09*88=95,7г ответ: 95,7г
Тема: КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ, ОСНОВЫ НОМЕНКЛАТУРЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цели урока:
образовательные: Сформировать понятия изомерии, структурной формулы, изомеров. Познакомить с принципами классификации органических соединений по строению углеродной цепи и по функциональным группам и на этой основе дать первоначальный обзор основных классов органических соединений. Дать общее представление об основных принципах формирования названий органических соединений по международной номенклатуре.
воспитательные: Формирование научной картины мира, воспитание чувства патриотизма на примере Бутлерова.
развивающие: Развивать умения учащихся сравнивать, обобщать, проводить аналогию.
Тип урока : урок комбинированный
Методы ведения :
общие: объяснительно-иллюстративный
частные : словесно-наглядный
конкретные : беседа
Оборудование : схема классификации органических соединений
План1.Организационный момент – 5 мин
2.Проверка домашнего задания – 25 мин
3.Объяснение и закрепление нового материала – 55 мин
4.Домашнее задание - 3 мин
5.Итоги урока – 2 мин
Ход урока1.Организационный момент: Приветствие, проверка посещаемости.
2. Проверка домашнего задания
? какая связь называется сигма связью?
какая связь пи?
Назовите механизмы разрыва химической связи
3.Объяснение нового материала:
Классификация органических веществНа прошлом занятии мы говорили, насколько велико число известных органических соединений. В этом безбрежном океане легко утонуть даже опытному химику. Поэтому ученые всегда стремятся классифицировать какое-либо множество «по полочкам», навести порядок в своем хозяйстве. Кстати, не мешает это делать и каждому из нас со своими вещами, чтобы в любой момент знать, где что находится.
Классифицировать вещества можно по разным признакам, например, по составу, строению, свойствам, применению - по столь привычной логической системе признаков. Т. к. в состав всех органических соединений входят атомы углерода, то, очевидно, важнейшим признаком классификации органических веществ может служить порядок их соединения, т. е. строение. По этому признаку все органические вещества разделены на группы в зависимости от того, какой остов (скелет) образуют углеродные атомы, включает ли этот остов какие-либо иные атомы, кроме углерода.
Давайте рассмотрим более подробно данную классификацию, используя следующую схему:
атомы углерода, соединяясь друг с другом, могут образовывать цепи различной длины. Если такая цепь не замкнута, вещество относится к группе ациклических (нециклических) соединений. Замкнутая цепочка углеродных атомов позволяет назвать вещество циклическим. Атомы углерода в цепочке могут быть связаны как простыми (одинарными), так и двойными, тройными (кратными) связями. Если в молекуле есть хотя бы одна кратная углерод-углеродная связь, она называется непредельной или ненасыщенной, в противном случае - предельной (насыщенной). Если замкнутую цепочку циклического вещества составляют только атомы углерода, оно называется карбоциклическим. Однако вместо одного или нескольких атомов углерода в цикле могут оказаться атомы других элементов, например азота, кислорода, серы. Их иногда называют гетероатомами, а соединение - гетероциклическим. В группе карбоциклических веществ есть особая «полочка», на которой расположены вещества с особым расположением двойных и одинарных связей в цикле. одно из таких веществ - бензол. Бензол, его ближайшие и дальние «родственники» называются ароматическими веществами, а остальные карбоциклические соединения - алициклическими.
В основе классификации лежит строение молекулы.
Ациклические соединения – соединения с открытой (незамкнутой) цепью углеродных атомов. Такие соединения называют также алифатическими соединениями или соединениями жирного ряда.
Предельные соединения – соединения, имеющие в своём составе одинарные связи.
Непредельные соединения – соединения, в которых присутствуют двойные или тройные (кратные) связи.
Циклические соединения – соединения, в которых углеродные атомы образуют циклы, бывают карбоциклическими и гетероциклическими.
Карбоциклические – циклические соединения, образованные только углеродными атомами, бывают алициклическими и ароматическими.
Гетероциклические соединения – циклы, в состав которых кроме атомов углерода входят и другие атомы – гетероатомы (азот, сера, кислород)
Основные классы органических соединений
Углеводороды – наиболее простые органические соединения, в состав которых входят только углерод и водород. Они бывают предельными (алканы), непредельными (алкены, алкины, алкадиены и др.) и ароматическими (арены).
При замене атомов водорода в углеводороде на другие атомы или группы атомов – функциональные группы – образуются многочисленные классы органических соединений (спирты, альдегиды, кетоны, карбоновые кислоты, эфиры, амины, аминокислоты и др).
Запишем таблицу:
| Класс соединений | Функциональная группа | Название функциональной группы | Пример соединения данного класса |
|
| Название |
||||
| Гидроксильная | Метанол (метиловый спирт) |
|||
| Гидроксильная | ||||
| Альдегиды | Карбонильная | Метаналь (формальдегид) |
||
| Карбонильная | CH 3 -C(=O)-CH 3 | Пропанон-2 (ацетон) |
||
| Карбоновые кислоты | Карбоксильная | Этановая кислота (уксусная кислота) |
||
| X (X=Cl, Br, F, I) | Галогенная | Хлорметан |
||
| Аминогруппа | Этиламин |
|||
| Амидогруппа | Ацетамид |
|||
| Нитросоединения | Нитрогруппа | Нитроэтан |
||
| Аминокислоты | COOH и - NH 2 | Карбоксильная и аминогруппы | Аминоуксусная кислота (глицин) |
|
Номенклатура органических веществ
Номенклатура - это система названий, употребляющихся в какой-либо науке.
На заре развития органической химии известных веществ живой природы было достаточно мало. Ученые той поры могли позволить себе придумывать для каждого вещества собственное название, которое часто даже не укладывалось в одно слово, да еще и не одно. Такие названия чаще всего отражали происхождение вещества или наиболее яркое его свойство: уксусная кислота, горькоминдальное масло (бензальдегид), глицерин (от греч.- сладкий), формальдегид (от латинского - муравей). Такие названия именуются тривиальными. Тривиальная номенклатура – исторически сложившиеся названия. Они широко распространены в химии для обозначения веществ простого строения. С накоплением экспериментального материала выяснилось, что многие вещества обладают похожими свойствами, т. е. принадлежат к одной группе (классу) соединений. На все вещества данного класса стали распространять похожие названия веществ.
Число известных органических соединений растет в геометрической прогрессии. Химикам разных стран стало трудно общаться, поскольку одни и те же вещества имели различные названия, а под одним названием подразумевали несколько веществ. Возникли большие сложности с названиями сложных молекул. Чтобы разрешить эту проблему, химики всех стран, входящих в Международный союз теоретической и прикладной химии (ИЮПАК), создали специальный комитет, который выработал основы единой для всех органических веществ номенклатуры. Эту номенклатуру называют международной или номенклатурой ИЮПАК.
Для того чтобы уметь пользоваться ею, нужно хорошо знать названия первых представителей гомологического ряда предельных углеводородов (от этана до декана) и нескольких простейших предельных радикалов (метил, этил, пропил).
Запишем таблицу:
Названия алканов и алкильных заместителей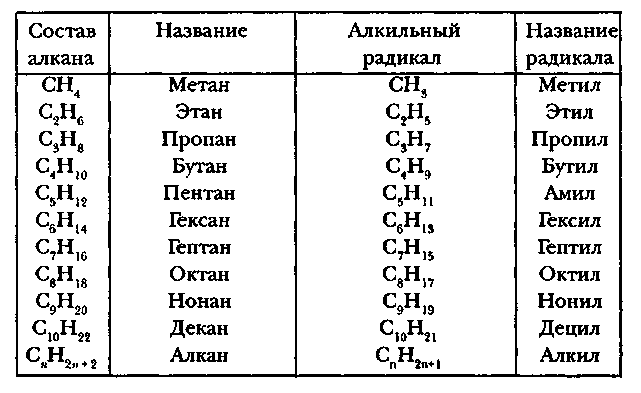
Основные принципы номенклатуры ИЮПАК
1.Основу названия вещества составляет название предельно го углеводорода с тем же числом углеродных атомов, что и в самой длинной цепи ациклической молекулы.
Положение заместителя, функциональных групп и кратных связей в главной цепи обозначается с помощью цифр.
Заместители, функциональные группы и кратные связи указываются в названии с помощью префиксов (те же приставки, но специфические, химические) и суффиксов.
При написании названия все цифры отделяются друг от друга запятыми, а от букв - дефисами.
СН 3 – СН = СН - СН 3 Н 2 N - СН 2 - СООН
CН 3 – СН 2 – СН 2 – СН 2 _ - СН 3 CН 3 – СН 2 – СН 2 – ОН
CН 3 – СН 2 – NН 2 CН 3 – СН 2 – СН 2 – NО 2
Рассмотрим изомерию органических веществ
? Что такое изомерия?
Пример: CН 3 – СН 2 – СН 2 – СН 2 - СН 3 CН 3 – СН 2 (СН 3) – СН 2 –- СН 3
3. Домашнее задание:
Л.А. Цветков «Органическая химия – 10» §3;
4. Итоги: Таким образом, сегодня мы познакомились с классификацией, номенклатурой и изомерией органических веществ. Оценки за урок.
