Взаимодействие спиртов с водой. Строение спиртов, характерные типы химических реакций
Спирты Цели урока Знать: строение спиртов, характерные типы химических реакций, применение спиртов на основе их свойств Уметь: устанавливать зависимость «состав – строение - свойства – применение», составлять молекулярные и структурные формулы спиртов, называть их, записывать уравнения реакций с участием спиртов, определять тип химической реакции Спиртами называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп –ОН, соединенных с углеводородным радикалом. Гомологический ряд предельных одноатомных спиртов Метанол, метиловый СН3ОН Этанол, этиловый С2Н5ОН Пропанол, пропиловый С3Н7ОН Бутанол, бутиловый С4Н9ОН Общая формула одноатомных спиртов СnН2n+1ОН или ROH Классификация спиртов По числу гидроксильных групп одноатомные двухатомные трехатомные По характеру углеводородного радикала предельные непредельные ароматические По характеру атома углерода, с которым связана гидроксильная группа Виды изомерии спиртов -изомерия положения ОН- группы, (начиная с С3) ; -углеродного скелета, (начиная с С4); -межклассовая изомерия с простыми эфирами Например, одну и ту же молекулярную формулу С2H6O имеют: СН3CH2–OH и CH3–O–CH3 этиловый спирт диметиловый эфир Получение спиртов В промышленности: * гидратацией алкенов СН2=СН2 + Н2О → СН3-СН2-ОН * сбраживание сахаристых веществ С6Н12О6 → 2С2Н5ОН+2СО2 * путем гидролиза крахмалосодержащих продуктов и целлюлозы с последующим сбраживанием образовавшейся глюкозы * метанол получают из синтез-газа СО + 2Н2 → СН3ОН В лаборатории: * из галогенопроизводных алканов, действуя на них AgOH или КОН С4Н9Вr + AgOH → С4Н9ОН+AgВr↓ * гидротацией алкенов СН2-СН=СН2 +Н2О → СН3 -СНОН-СН3 Химические свойства спиртов 1. Замещения: 2C2H5OH + 2Na 2C2H5O– Na + H2 этилат натрия 2. Взаимодействие с кислотами C2H5OH + НСl C2H5Сl + H2O СН3СООН + C2H5OH СН3СООC2H5 + H2O 3. Реакции окисления а) горение C2H5OH +3О2 2СО2 + 3H2O б) окисления оксидом меди (ІІ) O ⁄⁄ C2H5OH + СuO СН3–С - H + Сu +H2O уксусный альдегид 4. Дегидратация C2H5OH C2H4 + H2O C2H5OH + C2H5OH C2H5OC2H5 + H2O диэтиловый эфир Спиртам характерны следующие реакции: 1. Замещения: 2C2H 5OH + 2Na 2C2H5O– Na + H2 этилат натрия 2. Дегидратации: CH3CHCH2 | | H OH H2SO4 CH3CH=CH2 + H2O t > 140C 3. Этерификации: CH3–OH + СН3-СО-ОН CH3–СО-О-СН3 + H2О метанол 4. Окисления: R–СН2–OH уксусная кислот [O] R–СН=O -H2О альдегид метилацетат [O] R–СOOH карбоновая кислота Применение этанола Влияние этанола на организм человека Этиловый спирт является мощным наружным антисептиком и надежным консервантом. Легко понять: если вещество вызывает моментальное прекращение жизни и гибель микробов, то такое же действие оно окажет на наш организм. Всем известно, что в этиловом спирте десятилетиями сохраняются биологические структуры(кусочки тканей, органы) Это возможно только потому, что все процессы жизнедеятельности в спирте прекращаются В водке, коньяке, роме, вине, пиве, одеколоне, денатурате основным фармакологически активным веществом, определяющим привлекательность этих жидкостей, является этиловый спирт. При употреблении алкоголя мышление нарушается! Несовместимость между антисептическим действием и применением внутрь в качестве пищевого продукта люди не осознают! Смерть человека наступает при концентрации этанола в крови - 5 граммов на 1 литр крови. Этиловый спирт попадает во все органы и ткани!!! Вследствие этого при опьянении неизбежно нарушается работа всех клеток и органов любого человека. Ведь раб не тот, кто стонет под кнутом, Не тот отшельник, кто по воле неба, Живет в уединении глухом, И нищ не тот, кто просит корку хлеба. И тот и раб, и нищ, и одинок, Кто в жизни выбрал спутником порок. Проверь себя I уровень 1. Химическая формула этанола: а) СН3ОН; б) С2Н5ОН; в) С3Н7ОН 2. Спирты по сравнению с соответствующими углеводородами имеют температуру кипения выше за счет наличия: а) ковалентной связи; б) ионной связи; в) водородной связи 3. Реакция спирта с активными металлами относится к реакциям: а) замещения; б) присоединения; в) окисления II уровень 4. Какие продукты могут быть получены в результате реакции этанола с метанолом? Запишите соответствующее уравнение реакции, укажите условие его протекания. 5. Как классифицируют спирты по типу атома углерода, к которому присоединяется гидроксильная группа? 6. Написать уравнение реакции промышленного получения метанола из водяного газа, указав условия его протекания. III уровень 7. Составьте уравнения реакций, при помощи которых можно осуществить следующее превращение: СО2 С6Н12О6→С2Н5ОН →С2Н5ОNa ↓ С2Н5 Сl → С2Н4 IV уровень 8. Какова относительная молекулярная масса одноатомного спирта, из которого при действии металлического натрия получается 1.12л водорода? Назовите этот спирт Ответ І 1-б; 2-в; 3-а ІІ 4. С2Н5ОН +СН3ОН →С2Н5ОСН3 + Н2О t <140ºС, Н2SO4 (конц) 5. предельные, непредельные, ароматические 6. СО + 2Н2 → СН3ОН tº 220-300ºС, 5-10 МПа, Си, ZnO ІІІ 7. С6Н12О6 →2С2Н5ОН +2СО2 2 С2Н5ОН +2Na →2С2Н5ОН + Н2 С2Н5ОН + 3О2 → 2СО2 +3Н2О С2Н5ОН + НCl → С2Н5Cl +Н2О С2Н5Cl + КОН → С2Н4 + КCl + Н2О ІV 8. С4Н9ОН Домашнее задание Повторить по записям виды хим.связи и типы кристаллических решёток Придумать свой тест или сделать творческое задание по теме урока
А15. Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола
Характерные химические свойства предельных одноатомных спиртов
| Тип реакции | Уравнение |
| I. Реакции окисления | |
| 1. Горение (полное окисление) | 2СН 3 ОН + 3О 2 → 2СО 2 + 4Н 2 О С 2 Н 5 ОН + 3О 2 → 2СО 2 + 3Н 2 О |
| 2.Неполное окисление (CuO, растворы KMnO 4 , K 2 Cr 2 O 7). Первичные спирты – до альдегидов, вторичные – до кетонов. | t C 2 H 5 OH + CuO → CH 3 COH + Cu+H 2 О качественная реакция K 2 Cr 2 O 7 + 3C 2 H 5 OH + 4H 2 SO 4 → 3CH 3 COH + Cr 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O 3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. |
| 3. Ферментативное брожение (окисление) жидкостей, содержащих спирт (вино, пиво) | ферменты C 2 H 5 OH + О 2 → CH 3 CОOH + H 2 О |
| II. Реакции с разрывом связи О – Н | |
| 1. Как слабые кислоты взаимодействуют со щелочными и щелочноземельными металлами (со щелочами не взаимодействуют) | 2C 2 H 5 OH+2Na → 2C 2 H 5 ONa + H 2 этилат натрия |
| 2. Реакция этерификации-взаимодействие спиртов с органическими кислотами с образованием сложных эфиров | H 2 SО 4 конц., t CH 3 COOH + C 2 H 5 OH→ CH 3 COOC 2 H 5 + H 2 О |
| III. Реакция с разрывом связи С – О | |
| 1. Гидрогалогенирование | к. H 2 SO 4 , t C 2 H 5 OH + HC1→ C 2 H 5 C1+ H 2 О |
| 2. Дегидратация: а) внутримолекулярная – образуются алкены | к. H 2 SO 4 , t >150°C C 2 H 5 OH → C 2 H 4 + H 2 О |
| б) межмолекулярная - образуются простые эфиры | H 2 SО 4 , t <150°C 2C 2 H 5 OH → C 2 H 5 OC 2 H 5 + H 2 О диэтиловый эфир |
| IV. Дегидрирование спиртов | |
| 1. При пропускании паров спирта при 200-300 о С над металлическим катализатором (Cu, Ag, Pt) первичные спирты превращааются в альдегиды, а вторичные – в кетоны | Cu C 2 H 5 OH → CH 3 COH + H 2 |
| V. Дегидратация и дегидрирование (реакция Лебедева) | |
| Дегидратация и дегидрирование - образуются алкадиены | 2CH 3 -CH 2 - OH → CH 2 =CH-CH=CH 2 + 2H 2 O + H 2 бутадиен-1,3 |
Характерные химические свойства предельных многоатомных спиртов
Сходство этиленгликоля и глицерина с одноатомными спиртами:
1. Так, они реагируют с активными металлами :
2. Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:

3.Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:

Отличия этиленгликоля и глицерина от одноатомных спиртов:
1. Качественная реакция многоатомных спиртов , позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH) 2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
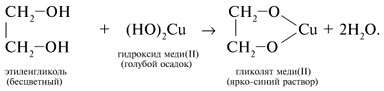
Окисление этиленгликоля
Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислой среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 - +12H 2 SO 4 →5HOOC – COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О
3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 →3KOOC – COOK +8MnO 2 +2КОН +8Н 2 О
