Осно́вные свойства спиртов. Спирты как слабые OH-кислоты
Образование межмолекулярной водородной связи в газовой и конденсированной фазе определяет различие в кислотности первичных, вторичных и третичных спиртов.
В водном растворе и конденсированной фазе кислотность уменьшается в ряду:
В таблице 1 приведены величины pKa некоторых спиртов, которые наглядно иллюстрируют уменьшение кислотных свойств при переходе от первичных к третичным спиртам.
Существует два различных объяснения влияния заместителей на кислотные свойства спиртов. Одно из них, наиболее традиционное, основано на индуктивном дейстии заместителей. Атом галогена, находящийся при -углеродном атоме спирта, обладает ярко выраженным -I эффектом. Последний поляризацией связей На1-С, С-С, С-0 приводит к поляризации гидроксильной группы и увеличению эффективного положительного заряда на атоме водорода гидроксильной группы. Поляризация гидроксильной группы способствует более легкой диссоциации с образованием алкоголят-аниона и протона. Поэтому р-хлорэтанол должен проявлять свойства более сильной кислоты, чем этанол, а -фторэтанол должен быть более сильной кислотой, чем р-хлорэтанол, так как фтор обладает более сильным -I эффектом, чем хлор. По этой самой причине 2,2,2-трифторэтанол, содержащий три атома фтора, должен быть гораздо более сильной кислотой, чем монофторэтанол. Данные, представленные в таблице 1, согласуются с такой интерпретацией.
Таблица 1. Кислотность спиртов в водном растворе
| ROH | pKa | ROH | pKa |
| (CH 3) 3 COH | 18,0 | FCH 2 CH 2 OH | 13,9 |
| (CH 3) 2 CHOH | 17,1 | CF 3 CH 2 OH | 12,4 |
| CH 3 CH 2 OH | 15,9 | CF 3 CH 2 CH 2 OH | 14,6 |
| CH 3 OH | 15,5 | CF 3 CH 2 CH 2 CH 2 OH | 15,4 |
| HOH | 15,7 | (CF 3) 3 COH | 5,4 |
| ClCH 2 CH 2 OH | 14,3 |
Индуктивный эффект имеет тенденцию к затуханию, если атом галогена более удален от гидроксильной группы. Действительно, 3,3,3-трифторпропанол оказывается более слабой кислотой, чем трифторэтанол, а 4,4,4-трифторбутанол практически не отличается по кислотности от незамещенного первичного спирта. Другое объяснение изменения кислотности спиртов никак не связано с индуктивным влиянием заместителей. Это объяснение основывается на стабильности алкоголят-анионов, образующихся при диссоциации спиртов. Анионы 2-фторэтанола и, особенно, 2,2,2-трифторэтанола гораздо более стабильны, чем незамещенный этилат-ион, так как положительный конец диполя связи C +d -F -d расположен ближе к отрицательно заряженному атому кислорода, чем его отрицательный конец. Поэтому электростатические силы притяжения преобладают над отталкиванием двух одноименно заряженных частиц, а это стабилизирует анион F 3 ССН 3 СO - по сравнению с анионом СН 3 СН 2 СO -

Приведенное объяснение носит название "эффекта поля" и оно не требует привлечения особых, часто умозрительных химических понятий типа нуклеофильного, мезомерного и других эффектов. Алкильные группы, обладающие +I эффектом, дестабилизируют алкоксид-ион и рКа третичного бутилового спирта в воде выше, чем для первичных и вторичных спиртов.
Спирты как слабые ОН-кислоты реагируют со щелочными, щелочноземельными металлами, алюминием, галлием, таллием с образованием ионных или ковалентных алкоголятов.

Алкоголяты могут быть получены при действии на спирты сильных оснований - гидридов или амидов щелочных или щелочноземельных металлов, а также реактивов Гриньяра.
Спирты проявляют свойства не только слабых кислот, но и слабых оснований Льюиса, т.е. они обладают амфипротонными свойствами. Как основания Льюиса спирты образуют донорно-акцепторные комплексы с галогенидами и оксигалогенидами фосфора, серы или с другими кислотами Льюиса. С сильными минеральными кислотами спирты образуют соли алкоксония. На этих свойствах основаны многие важные реакции замещения гидроксильной группы на галоген, дегидратации и этерификации спиртов с помощью органических и минеральных кислот и их производных.
2. Замещение гидроксильной группы на галоген
Замещение гидроксильной группы на галоген относится к числу наиболее важных реакций органического синтеза. Существует большое число методов замены гидроксильной группы на галоген. Они различаются регио- и стереоселективностью, а выходы спиртов коляблются в весьма широких пределах.
А. Получение алкилгалогенидов из спирта и галогеноводородов
Реакционная способность галогеноводородов уменьшается в ряду
Скорость реакции с HF слишком мала для прямого превращения спиртов в алкилфториды. Скорость реакции замещения резко снижается в ряду
Для получения третичных алкилгалогенидов обычно достаточно насытить третичный спирт газообразным галогеноводородом при 0-10 о или обработать водной соляной или бромистоводородной кислотами в течение короткого времени при 0-20 о. Для получения первичных и вторичных алкилбромидов и алкилиодидов обычно требуется нагревание смеси спирта, концентрированной бромистоводородной кислоты и концентрированной серной кислоты в течение нескольких часов. Вместо концентрированных водных растворов HBr можно использовать бромиды натрия и калия и концентрированую серную кислоту.

Спирты как слабые основания Льюиса при протонировании образуют соли алкоксония. Протонирование гидроксильной группы превращает плохую уходящую группу OH в хорошую уходящую группу - воду.
Механизм последующего нуклеофильного замещения зависит от природы радикала спирта. Для первичных спиртов реализуется S N 2 - механизм замещения воды в катионе алкоксония на галоген.

Хлорид-ион в гидроксилсодержащих растворителях сильно сольватирован и проявляет свойства более слабого нуклеофила по сравнению с бромид- и иодид-ионами. Поэтому для получения алкилхлоридов при взаимодействии первичных спиртов с соляной кислотой используют электрофильный катализатор - безводный хлорид цинка. Смесь соляной кислоты и хлорида цинка носит название реактива Лукаса. Хлорид цинка как жесткая кислота Льюиса координируется по атому кислорода, облегчая тем самым замещение гидроксильной группы.

Реакционная способность спиртов по отношению к реактиву Лукаса уменьшается в ряду
Третичные и, по-видимому, вторичные спирты взаимодействуют с галогеноводородами по механизму S N 1 с образованием карбокатиона в качестве интермедиата. При этом в реакционной смеси в высокой концентрации находится галогенид-ион - более сильный нуклеофильный агент, чем вода. Поэтому карбокатион стабилизируется не выбросом протона или рекомбинацией с молекулой воды, а взаимодействием с галогенид-ионом как наиболее сильным нуклеофилом.
Характерной особенностью процессов с участием карбокатионов являются перегруппировки. Эта реакция может также сопровождаться перегруппировками. Атом водорода при соседнем атоме углерода может мигрировать в виде гидрид-иона к карбокатионному центру. Это смещение называется 1,2-гидридным сдвигом. Роль подобным перегруппировок возрастает тогда, когда в результате гидридного сдвига образуется более стабильный карбокатион.

Так, например, при нагревании 3-метилбутанола-2, насыщенного газообразным бромистым водородом, в качестве единственного продукта реакции образуется 2-бром-2-метилбутан вместо нормального продукта замещения гидроксила на бром - 2-бром-3-метилбутан. Ниже приведена предполагаемая последовательность превращений, включающая изомеризацию вторичного крбокатиона в более стабильный третичесый карбокатион за счет 1,2-гидридного сдвига.

Перегруппировка может наблюдаться и в том случае, если два карбокатиона близки по стабильности. При нагревании с бромистоводородной кислотой пентанол-2 и пентанол-3 образуют смесь 2-бром- и 3-бромпентана за счет перегруппировки двух вторичных карбокатионов.


Перегруппировка может происходить не только за счет 1,2-миграции гидрид-иона, но также в результате скелетной изомеризации, когда мигрирует алкильная группа. Так, например, если структурные факторы способствуют образованию третичного карбокатиона, первичный спирт претерпевает перегруппировку Вагнера-Меервейна.

Пентанол-1 в тех же условиях образует только 1-бромпентан без продуктов перегруппировки и это превращение протекает по S N 2-механизму. Однако первичные спирты с разветвленной цепью дают некоторое количество изомерного галогенида.
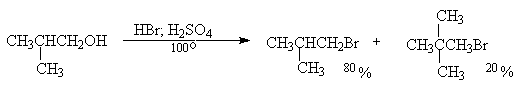
Таким образом, замещение гидроксильной группы спиртов на галоген под действием галогеноводородов без изомеризации осуществляется только для третичных спиртов и нормальных алканолов-1. Для получения индивидуальных алкилгалогенидов из спиртов, способных к изомеризации, следует применять другие методы.
Б. Получение алкилгалогенидов из спиртов и галогенидов фосфора
Для превращения спиртов в алкилгалогениды применяют различные тригалогениды, пентагалогениды и оксигалогениды фосфора: PBr 3 , PCl 5 , PCl 3 , POCl 3 , PI 3 (получается из красного фосфора и иода непосредственно во время реакции). Для получении первичных и вторичных галогенидов на три моля спирта можно расходовать только один моль трехбромистого или трехиодистого фосфора.
Механизм замещения гидроксильной группы первичных или вторичных спиртов на бром или иод в реакциях с PBr 3 или PI 3 в точности не установлен. Наиболее разумное предположение заключается в том, что первоначально из спирта образуется трииалкилфосфит (RO) 3 P и три молекулы HX. Далее происходит постадийное нуклеофильное замещение фосфитной группировки в протонированной форме фосфита под действием галогенид-иона.
Замещение двух других фосфитных группировок происходит по аналогичному механизму. Реакция катализируется третичными аминами: пиридином, N,N-диметиланилином, триэтиламином и др. и для вторичных спиртов сопровождается 100%-ной инверсией конфигурации асимметрического атома углерода. Принимая во внимание, что PI 3 не стабилен даже при 20 о С, замещение гидроксильной группы на иод проводят при взаимодействии первичного или вторичного спирта, красного фосфора и иода.


При обработке первичных спиртов PCl 3 образуются соответствующие диалкилфосфиты и лишь одна молекула спирта превращается в алкилхлорид; вторичные спирты при этом, в основном, дегидратируются.
Предполагают, что сначала образуется триалкилфосфит, который только частично расщепляется выделяющимся хлористым водородом.
Если проводить эту реакцию в присутствии оснований, связывающих выделяющийся хлористый водород, то образуются только триалкилфосфиты.
Вторичные спирты в реакции с PCl 3 подвергаются, главным образом, дегидратации с образованием алкенов. Это неудивительно, если принять во внимание, что галогениды и оксигалогениды фосфора проявляют свойства типичных кислот Льюиса, способствующих этому нежелеательному процессу.
Замещение гидроксильной группы под действием РВгз и других галогенидов и оксигалогенидов фосфора происходит с инверсией конфигурации у асимметрического атома углерода, связанного с гидроксильной группой и часто сопровождается перегруппировками. Так, пентанол-3 в реакции с трехбромистьш фосфором в эфире образует 85% 3-бромпентана и 15% 2-бромпентана - продукта перегруппировки. З-Метилбутанол-2 и неопентиловый спирт с трехбромистьм фосфором также дают смесь двух изомерных галогенидов, в которых доминирует продукт изомеризации.

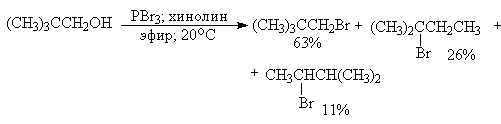
Применение третичных оснований, таких, как пиридин, хинолин, N,N-диметиланилин в смеси с РВг 3 , РI 3 , РС1 5 , РОС1 5 , несколько уменьшает долю продукта перегруппировки, но не устраняет ее полностью. Таким образом, галогениды и оксигалогениды фосфора не могут быть рекомендованы в качестве региоселективных или региоспецифических реагентов для замещения гидроксильной группы в спиртах.
В.Получение алкилхлоридов из спиртов и тионилхлорида
Тионилхлорид превращает первичные и вторичные спирты в алкилгалогениды с выходом 70-90%. Следует различать две разновидности этой реакции: в присутствии или отсутствии основания (пиридин, триэтиламин, диметиланилин, и др.).
Ранее полагали, что в отсутствии растворителей или в таких растворителях, как петролейный эфир и ароматические углеводороды, замещение гидроксильной группы на хлор с SOCl 2 протекает как внутримолекулярное S N i нуклеофильное замещение в хлорсульфите, который, как было установлено, первоначально образуется при взаимодействии SOCl 2 со спиртом при низкой (-30 о С и ниже) температуре. По этому механизму внутримолекулярное замещение двуокиси серы хлором в хлорсульфите должно происходить с той же стороны, откуда отщепляется уходящая группа SO 2 . Следовательно, внутримолекулярное нуклеофильное замещение должно сопровождаться полным сохранением конфигурации у асимметрического атома углерода. Для этого процесса был предложен механизм с четырехзвенным переходным состоянием.
В настоящее время установлено, что процесс такой механизм не реализуется, а реакция протекает с образованием в качестве интермедиата ионных пар.
Детальное исследование стереохимии термического разложения оптически активного 2-октилхлорсульфита

показало явное несоответствие с механизмом S N i. В отсутствие растворителя или петролейном эфире образуется 2-хлороктан с обращением конфигурации, что определенно указывает на замещение хлорсульфитной группы в результате атаки хлорид-ионом с тыла. При термическом разложении 2-октилхлорсульфита в диоксане наблюдается сохранение конфигурации, но этот результат следует рассматривать как следствие двойной инверсии конфигурации. В первой стадии диоксан в качестве нуклеофильного агента замещает хлорсульфит в обычном процессе бимолекулярного нуклеофильного замещения.
Во второй стадии хлорид-ион замещает диоксан в оксониевом катионе.
Двойное обращение равносильно сохранению конфигурации у асимметрического атома углерода. Аналогично можно описать превращение спиртов в хлориды и бромиды под действием хлорокиси и бромокиси фосфора.
При замещении гидроксила во вторичных спиртах с помощью тионилхлорида или хлорокиси фосфора в присутствии оснований наблюдается обращение конфигурации. В этом случае имеет место обычное бимолекулярное нуклеофильное замещение в хлорсульфите под действием хлорид-иона как нуклеофила. Источником хлорид-иона служит гидрохлорид третичного амина, образующийся при взаимодействии спирта, тионилхлорида и третичного амина.

Замещение гидроксила на галоген в реакции спиртов с галогенидами и оксигалогенидами фосфора, мышьяка, серы и селена в присутствии оснований всегда приводит к инверсии конфигурации у хирального атома углерода. Для вторичных спиртов с замещением конкурирует элиминирование с образованием алкенов, которое становится доминирующим для третичных спиртов.
Получение трет-алкилхлоридов и трет-алкилбромидов при взаимодействии третичных спиртов с SOCl 2 , POCl 3 , POBr 3 , PBr 5 не эффективно, так как главным направлением реакции становится элиминирование. Трет-алкилгалогениды получаются при взаимодействии спиртов с газообразными HCl и HBr в индифферентном растворителе при 0-10 о С.
Перегруппировки и изомеризации при замещении гидроксильной группы первичных и вторичных спиртов на хлор под действием тионилхлорида в присутствии пиридина или другого третичного основания при 0 о -(-10 о) происходят в значительно меньшей степени по сравнению с замещением с PBr 3 или PCl 5 в смеси с пиридином.
Г. Получение алкилгалогенидов из спиртов и квазифосфониевых солей
Для региоселективного замещения OH-группы в последние годы широкое распространение получили квазифосфониевые соли - аддукты ароматических третичных фосфинов с галогенами, тетрагалогенметанами или N-галогенсукцинимидом. Реакции протекают в мягких условиях и с высокой степенью инверсии конфигурации. Трифенилфосфин образует прочные комплексы с бромом и хлором, которые превращают спирты в алкилгалогениды с высокой региоселективностью. Метод особенно удобен для для вторичных и первичных спиртов, но не эффективен для третичных спиртов, для которых можно ожидать изомеризации и перегруппировки. Иногда в качестве добавки используют пиридин как слабое основание.
В первой стадии реакции спирт вытесняет галогенид-ион из ковалентно построенного соединения пятивалентного фосфора с образованием ионного фосфониевого интермедиата или ковалентного фосфорана, который затем нуклеофильно атакуется галогенид-ионом с отщеплением трифенилфосфиноксида.
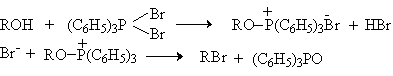
Согласно этой схеме конечным стереохимическим результатом должно быть обращение конфигурации у асимметрического атома углерода, при котором происходит замещение гидроксила на галоген.
Аналогично спирты можно превратить в галогениды с обращением конфигурации при взаимодействии с комплексами трифенилфосфина и тетрагалогенметаном, CCl 3 CN или CCl 3 COOEt. В этом случае реакционная способность спиртов уменьшается в ряду:


Замещение гидроксила на хлор с помощью систем трифенилфосфин-четыреххлористый углерод и трифенилфосфин - CCl 3 COOC 2 H 5 в первичных аллиловых спиртах происходит практически без аллильных перегруппировок.

Отсутствие аллильных перегруппировок для первичных аллиловых спиртов выгодно отличает этот способ замещения гидроксильной группы на галоген от других.
Д. Замещение сульфонатной группы в алкилсульфонатах на галоген
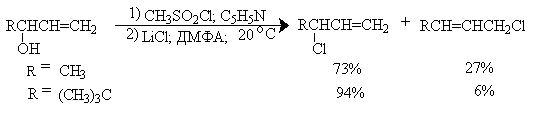
Этот метод широко используется для замещения гидроксильной группы в первичных и вторичных спиртах на галогены. Спирты сначала этерифицируют с помощью хлорангидридов сульфокислот, т.к. остаток сульфокислоты является превосходной уходящей группой и легко замещается в мягких условиях под действием галогенид-иона, причем алкилсульфонаты могут быть выделены и очищены. Замещение на галоген обычно осуществляется в ДМФА, ДМСО или ацетоне и сопровождается полной инверсией конфигурации.

Для вторичных аллиловых спиртов замещение сульфонатной группы на галоген, как правило, сопровождается перегруппировкой, степень которой зависит от структурных факторов и условий проведения реакции (низкая температура способствует большей региоселективности).
Для получения первичных и вторичных алкилфторидов и, в меньшей степени, алкилхлоридов чрезвычайно эффективным оказался метод межфазного переноса с использованием в качестве катализатора краун-полиэфиров или солей тетраалкиламмония или фосфония. Для получения алкилфторидов в качестве катализатора переноса из твердой фазы в раствор используют краун-полиэфиры. Но для получения хлоридов можно использовать и соли тетраалкиламмония.
|
Т кип., о С |
||
|
СН 3 СН 2 ОН | ||
|
Диметиловый эфир (метоксиметан) | ||
|
Пропанол-1 |
СН 3 СН 2 СН 2 ОН | |
|
Метилэтиловый эфир (метоксиэтан) |
СН 3 СН 2 ОCH 3 | |
|
Бутанол-1 |
CH 3 (CH 2) 3 OH | |
|
Диэтиловый эфир (этоксиэтан) |
СН 3 СН 2 ОCH 2 CH 3 |
Кислотно-основные свойства спиртов
в водном растворе кислотность спиртов изменяется следующим образом:
H 2 O > СН 3 ОН > СН 3 СН 2 ОН > (СН 3) 2 СНОН > (СН 3) 3 СОН
Формально, такой последовательности изменения кислотности спиртов можно было бы ожидать на основании увеличения индукционного эффекта радикалов в этом ряду, что, в свою очередь, должно приводить к увеличению электронной плотности на атоме кислорода спирта. Вследстсвие этого долж-но наблюдаться уменьшение кислотности спиртов. Однако более вероятным представляется образование менее прочной водородной связи в этом направ-лении, вследствие увеличения пространственных препятствий по мере увеличения объёма углеводородного радикала в ряду:
CH 3 < C 2 H 5 < (CH 3) 2 CH < (CH 3) 3 C
Образование водородной связи всегда предшествует переносу протона в гидроксилсодержащих растворителях. В Таблице 2 приведены данные о кислотности простейших спиртов, которые подтверждают это положение.
Таблица 2
Кислотность спиртов
|
(СН 3) 3 СОН | |
|
(СН 3) 2 СНОН | |
|
СН 3 СН 2 ОН | |
Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
Для количественного превращения спирта в алкоголят требуется использова-ние гораздо более сильных оснований, таких как гидриды или амиды щелоч-ных или щелочноземельных металлов или реактивов Гриньяра.

По отношению к сильным минеральным кислотам спирты проявляют свойства оснований и образуют соли алкоксония:
основание кислота кислота" основание"
Эта реакция является первой стадией в реакциях спиртов, протекащих в кислой среде, т.е., при замещении гидроксильной группы на галоген, дегидратации спиртов и образовании простых эфиров.
Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
Известно много способов замены гидроксильной группы спирта на галоген. Эти методы замещения гидроксила на галоген основаны на реакции спиртов с галогеноводородами, а также с галогенидами фосфора и оксогалогенидами фосфора и серы.
Получение алкилгалогенидов из спирта и галогеноводородных кислот
ROH + HHal → RHal + Н 2 O
Реакционная способность галогеноводородов уменьшается в ряду HI > HBr > HC1 >> HF. Скорость реакции замещения возрастает в ряду первич-ный > вторичный > третичный спирт. Для получения третичных алкилгало-генидов обычно достаточно обработать третичный спирт концентрирован-ным водным раствором соляной, бромистоводородной или йодистоводород-ной кислоты при комнатной температуре. Для получения первичных и вторичных алкилбромидов и алкилйодидов обычно требуется нагревание смеси спирта с концентрированной бромистоводородной или йодисто-водородной кислотой. Вместо концентрированных водных растворов НВr и HI можно использовать бромиды и йодиды натрия или калия и концентрированную серную или фосфорную кислоту. Выходы алкилгалогенидов по этому методу обычно составляют 75-90%. Отдельные примеры приведены ниже.
Первой стадией реакции является образование из спирта иона алкоксония
Следующей стадией для первичных спиртов и некоторых вторичных является S N 2 реакция замещения воды в катионе алкоксония на галоген:
для получения алкилхлоридов при взаимодействии первичных спиртов с соляной кислотой используют электрофильный катализатор - безводный хлорид цинка. Смесь соляной кислоты и хлорида цинка носит название реактива Лукаса. В отсутствии катализатора реакция протекает с гораздо меньшей скоростью.
Третичные спирты и некоторые вторичные взаимодействуют с гало-геноводородом по механизму S N l с образованием в качестве интермедиата карбокатиона, который далее с анионом галогена образут конечный продукт.

Химические свойства спиртов - 1. Кислотность спиртов
Спирты
Этот урок будет полезен всем тем, кто хочет самостоятельно пройти тему «Химические свойства спиртов - 1. Кислотность спиртов». При помощи этого материала вы узнаете, какими химическими свойствами характеризуются спирты. Будет введено понятие о кислотности спиртов.
Тема: Спирты
Урок: Химические свойства спиртов - 1. Кислотность спиртов
Рис. 1. Реакция натрия со спиртом (фото В.В. Загорского)
Спирт и вода в реакциях с натрием отдают ион водорода, т.е. в данной реакции они проявляют кислотные свойства. Продукт реакции спирта с натрием - соль (Рис. 1).
Общее название солей спиртов - алкоголяты. Реакции спиртов со щелочными металлами довольно широко используются в лабораторной практике. Остатки щелочных металлов опасно уничтожать, вводя их в реакцию с водой, поскольку вода очень активно взаимодействует с ними. Поэтому чаще всего для этих целей используют этиловый спирт.
CH 3 CH 2 -O-H+NaOH CH 3 CH 2 -O-Na+H 2 O
Реакция не идет!
Причина: спирт - более слабая кислота, чем вода, и не может вытеснить воду.
Алкоголяты вступают в обратную реакцию:
CH 3 -CH 2 -ONa+Н 2 О → CH 3 -CH 2 -OH+NaOH
CН 3 СН 2 ОNa этилат натрия.
В чем причина различия активности воды и спиртов?
Причина кислотных свойств воды и спиртов - высокая полярность связи О-Н:

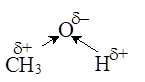
Чем больше величина положительного заряда на атоме водорода, тем легче вещество будет отдавать протон и, следовательно, сильнее проявлять кислотные свойства.
Чем разветвленнее углеводородный радикал, тем менее полярна связь О-Н и меньше кислотные свойства спирта:
НОН > CH 3 OH > CH 3 -CH 2 OH > (CH 3) 2 -CHOH > (CH 3) 3 -COH
Включение в молекулу спирта электроотрицательного атома делает увеличение полярности связи О-Н и, как следствие, усиление кислотных свойств:
Cl - CH 2 - CH 2 OH > CH 3 OH
СН 2 ОН-СНОН-СН 2 ОН > ОН-CH 2 -CH 2 OH > Cl-CH 2 -CH 2 OH
Подведение итога урока
При помощи этого материала вы узнали, какими химическими свойствами характеризуются спирты. Было введено понятие о кислотности спиртов.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 2, 16 а) (с. 85) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Что такое водородная связь и как можно объяснить её образование?
3. Один из атомов водорода в молекулах спиртов является более подвижным. Объясните почему?
