Химия работа органические соединения спирты и фенолы. Спирты и фенолы. Химические свойства спиртов и фенолов
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (-ОН), связанных с углеводородным радикалом. Вещества, у которых гидроксил находится непосредственно у бензольного кольца, называются фенолами.
В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты:
Гидроксигруппа является одной из многих функциональных групп, изученных в органической химии. Присутствие гидроксигруппы указывает на то, что молекула представляет собой либо спирт, либо карбоновую кислоту. В общей функциональной группе алкоголя имеются три подгруппы: первичный, вторичный и третичный спирты. Спирт классифицируется как первичный, вторичный или третичный в зависимости от углерода, к которому он присоединен. Спирт является первичным, если он присоединен к углероду только с одной углерод-углеродной связью.
Реакции, иллюстрирующие кислотные свойства
Точно так же алкоголь является вторичным, если углерод, к которому он присоединен, связан с двумя другими атомами углерода и третичным, если оставшиеся три связи углерода связаны с другими атомами углерода. Следующие примеры первичных, вторичных и третичных спиртов представляют собой этанол, изопропанол и трет-бутиловый спирт соответственно.
первичные R-CH2-OH,
вторичные
R
I
CH-OH,
I
R’
и третичные R’-
R
I
C-OH.
I
R’’
Низшие спирты (до С12) - жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О-Н
…….. : O-H ….. :
I
R O-H ……
I
R
Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается.
Связь между кислородом и водородом значительно короче связей между углеродом и водородом. Гидроксильные группы по своей природе полярны. Кислород в ковалентной связи сильно электроотрицателен; тем самым, вытягивая большую часть электронной плотности, разделяемой в ковалентной связи по отношению к самой себе. Из этой информации становится ясно, что кислород несет значительный частичный отрицательный заряд, а водород - частичный положительный заряд той же величины.
Наличие высокоэлектрогативной группы позволяет спиртам связывать водород с другими молекулами. Например, в этаноле отрицательно заряженный кислород на одной молекуле этанола притягивается к положительно заряженной молекуле водорода на другой молекуле этанола. Способность спиртов к водородной связи между собой объясняет их высокие температуры плавления. Спирты также имеют более высокие точки кипения, чем углеводороды и простые эфиры, которые содержат сопоставимое количество атомов углерода.
Таблица. Физические свойства спиртов и фенолов
| Название | Формула |
d 4 20 |
t пл ° C |
t кип ° C |
| Спирты | ||||
| метиловый | СН 3 OH |
0, 792 Растворимость спиртов в воде интересна тем, что спирты имеют гидрофобные и гидрофильные центры, делая их амфипатическими или амфифильными. Углеводородная часть спирта является неполярной и, таким образом, сопротивляется растворению в воде; полярная спиртовая группа является гидрофильной и тем самым способствует растворению в воде. В небольшой молекуле, такой как пропанол, спирт растворяется, потому что полярная спиртовая группа перевешивает очень короткую водородную цепь. Однако по мере того, как углеводородная цепь увеличивается за бутанолом до пентанола и гексанола, спирты становятся практически несмешивающимися в воде. |
||
| этиловый | С 2 Н 5 OH |
0,79 |
||
| пропиловый | СН 3 СН 2 СН 2 OH |
0,804 |
||
| изопропиловый | СН 3 -СН(ОH)-СH 3 |
0,786 |
||
| бутиловый | CH 3 CH 2 CH 2 CH 2 OH |
0,81 Спирты представляют собой амфотерные виды, которые могут существовать как кислоты, так и основания. При низких значениях рН или в окружении сильных кислот они могут быть протонированы к ионам алкилоксония. Напротив, при высоком значении рН и при сильных основаниях они могут существовать в виде ионов алкоксида. Отдельные представители класса спиртовОни имеют некоторое сходство со спиртами в химической реактивности при кислороде, но они намного более кислые и гораздо менее базовые. Они кажутся енолами и должны быть неустойчивыми относительно кетообразной формы, но усиление ароматичности в том, что она находится в еноле, благоприятствует форме енола относительно кето. Изучение резонансных форм указывает на то, что гидроксил подает электронную плотность в кольцо, поэтому гидроксильная группа активируется и направляет орто-пара. |
||
| вторбутиловый | CH 3 CH 2 CH(CH 3 )OH |
0,808 |
||
| третбутиловый | (СН 3 ) 3 С-OH |
0,79 |
||
| циклогексанол | С 6 Н 11 OH |
0,962 |
||
| бензиловый | C 6 H 5 CH 2 OH |
1,046 РНК фенолов составляет около 8 Фенолов являются значительно более кислотными, чем спирты. Это связано с тем, что феноксид стабилизирован резонансом. Прямое согласованное смещение уходящих групп на ароматические кольца невозможно. В подходящих замещенных кольцах уходящие группы могут быть заменены гидроксилом, включающим нуклеофильные процессы, посредством двухэтапного механизма: нуклеофильное ароматическое замещение. Межмолекулярная дегидратация спиртов. Образование простых эфировФенолы подвергаются многим из тех же реакций, что и спирты, особенно там, где речь идет о нуклеофитии соответствующего феноксида. Анилирование фенола через реакцию типа Уильямсона. Реакция включает катализатор, состоящий из меди, оксида цинка и оксида хрома. |
||
| этиленгликоль | HOCH 2 CH 2 OH |
1,113 |
15,5 |
|
| глицерин | НО-СН 2 -CH(ОН)-СН 2 OH |
1,261 |
18,2 |
|
| Фенолы | ||||
| фенол | С 6 Н 5 OH |
1,05(43°) Способы получения гидроксипроизводныхИзменение катализатора на родий или рутений приводит к 1, 2-этандиолу, важным промышленным химическим веществам, являющимся основным компонентом автомобильного антифриза. Этанол готовят в больших количествах путем ферментации сахаров или катализируемой фосфорной кислотой гидратации этилена. В меньшем промышленном масштабе мы можем готовить спирты из самых разных исходных материалов. Эти методы не так широко используются, как можно было бы подумать, однако, поскольку требуемые галогениды часто доступны только из соответствующих спиртов. Они также страдают от обычных недостатков нуклеофильного замещения: бимолекулярная элиминация может быть основной побочной реакцией затрудненных систем и третичных галогенидов из карбокатионов, которые могут подвергаться реакциям Е1. |
||
| пирокатехин | о - С 6 Н 4 (OH) 2 | |||
| резорцин | м - С 6 Н 4 (OH) 2 | |||
| гидрохинон | n - С 6 Н 4 (OH) 2 | |||
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов - CnH2n+1OH.
Изомерия
1. Изомерия углеродного радикала (начиная с C4H9OH).
2. Изомерия положения гидроксильной группы, (начиная с С3Н7ОН).
3. Межклассовая изомерия с простыми эфирами (СН3-СН2-ОН и СН3-О-СН3).
Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение гидроксильной группы указывают цифрой) или к названию углеводородного радикала добавляется слово "спирт"; также часто встречаются тривиальные (бытовые) названия:
СН3-ОН - метанол, метиловый спирт;
СН3-СН2-ОН - этанол, этиловый спирт;
СН3-СН-СН3 - пропанол-2, изопропиловый спирт.
I
OH
Некоторые из этих недостатков преодолеваются использованием полярного апротонного растворителя. Хотя это и может быть сделано, для этого требуются высокие давления и специальные катализаторы. Более удобным способом является полярный процесс, в котором ионы гидрида и протон доставляются к двойной связи либо одновременно, либо последовательно. В синтезе спиртов используются металлоорганические реагенты магния и лития. Поскольку металл в металлоорганических соединениях чрезвычайно электроположительный, углерод может реагировать так, как если бы он несет отрицательный заряд.
Получение
В промышленности.
1. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250°C и давлении 5-10 МПа:
СО + 2Н2 ® СН3ОН
Ранее метанол получали сухой перегонкой древесины без доступа воздуха.
2. Этанол получают:
a) гидратацией этилена (Н3РО4; 280°C; 8 МПа)
СН2=СН2 + Н2О ® СН3-СН2-ОН
B) брожением крахмала (или целлюлозы):
Химические свойства простых эфиров
Эти металлоорганические соединения могут атаковать карбонильную группу альдегидов и кетонов. Важной особенностью этой реакции является то, что в процессе образуется новая углерод-углеродная связь. Синтез третичного спирта из кетона. Первый этап этой реакции включает нуклеофильный углерод, атакующий карбонильный углерод кетона или альдегида с образованием углерод-углеродной связи. Одновременно два электрона из углерод-кислородной двойной связи подталкиваются электронами от атакующего углерода с образованием алкоксида металла с металлом из металлоорганического соединения.
крахмал ® С6Н12О6(глюкоза) --ферменты® 2С2Н5ОН + 2СО2-
(источник крахмала - зерно, картофель)
В лаборатории.
1. Гидратация алкенов (согласно правилу Марковникова):
СH3-СH=CH2 + H2O --H+® СH3-
CH- СH3
I
OH
2. Гидролиз галогенопроизводных углеводородов:
СH3-СH2-Br + H2O « СH3-CH2-OH + HBr
Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.
При водной обработке спирт образуется путем гидролиза алкоксида металла. Различные типы спиртов могут быть образованы путем изменения соединения, реагирующего с металлоорганическим соединением. Например, реакция между металлоорганическим соединением и формальдегидом приведет к первичному спирту. Реакция с любым другим типом альдегида приведет к образованию вторичных спиртов; реакция с кетонами приведет к образованию третичных спиртов.
Важность гидроксилирования может быть выражена путем выделения лекарств для предотвращения накопления токсических веществ. Гидроксилирование помогает повысить растворимость в воде соединений путем добавления гидроксигрупп к конкретным областям соединений. Таким образом, в печени гидроксилирование помогает ускорить выделение лекарства, которое мы глотаем, делая его более растворимым.
3. Восстановление карбонильных соединений:
Альдегиды образуют первичные спирты, а кетоны - вторичные.
O
II
-C
I
H
--2[H]® СH3-CH2-
-CH2OH
CH3 --2[H]® CH3-
Свойства спиртов ROH определяются наличием полярных связей Od--Hd+ и Cd+-Od-, и неподеленных электронных пар на атоме кислорода.
При реакции спиртов возможно разрушение одной из двух связей: C-OH (с отщеплением гидроксильной группы) или O-H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
Если бы это не было для этого процесса, проглоченные лекарства оставались бы в наших телах намного дольше и имели бы гораздо больший шанс на накопление токсичных веществ. Гидроксилирование также может быть селективным при добавлении гидроксильных групп к молекуле. Протеин, подвергающийся гидроксилированию, может контролировать порядок добавления гидроксильных групп, а также положения, в которые они добавляются. Это ключевая функция процесса гидроксилирования, поскольку он позволяет молекулам подвергаться окислению в определенных областях молекула, а также позволяет молекулам связываться или взаимодействовать с другими соединениями в определенных ориентациях.
I. Реакции с разрывом связи RO-H
1. Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения - алкоголяты. Со щелочами спирты не взаимодействуют.
2СH3CH2CH2OH + 2Na ® 2СH3CH2CH2ONa + H2-
2СH3CH2OH + Сa ® (СH3CH2O)2Ca + H2-
В присутствии воды алкоголяты гидролизуются:
(СH3)3С-OK + H2O ® (СH3)3C-OH + KOH
Это означает, что спирты - более слабые кислоты, чем вода.
2. Взаимодействие с органическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
Самый простой случай - когда молекула содержит только углеводороды, а гидроксигруппа является единственной функциональной группой, что делает ее чисто спиртом. В общем случае наличие функциональных групп обозначается характеристическим суффиксом, который различен для каждой функциональной группы, и числом, обозначающим расположение функциональной группы на молекуле. Для спиртов характерный суффикс - это -ол.
Случай 1: Углеводороды и спирты В этом случае подсчитывается самая длинная цепь углеводородов - это становится первичной углеводородной цепью молекулы. Тогда самая длинная углеродная цепь пронумерована с целью размещения как можно меньшего числа на гидроксильной группе. Поскольку алкоголь является единственной функциональной группой, не имеет значения, какое из двух имен используется.
OC2H5 ¬H2SO4® CH3-
O-C2H5(уксусноэтиловый эфир (этилацетат)) + H2O
В общем виде:
II. Реакции с разрывом связи R-OH.
1. С галогеноводородами:
R-OH + HBr « R-Br + H2O
2. С концентрированной серной кислотой:
\ //
S
/ \\
\ //
S (этилсерная кислота) + H2O
/ \\
\ //
S
/ \\
\ //
S (диэтилсерная кислота(диэтилсульфат)) + H2O
/ \\
C2H5O-
III. Реакции окисления
Предполагается, что 2 соответствует расположению гидроксигруппы. Однако это правило не всегда выполняется, когда присутствуют другие функциональные группы. Случай 2: Это более сложно, потому что существует иерархия функциональных групп в органической химии. Каждая функциональная группа, когда она изолирована, должна быть помечена как наименьшее число. Однако некоторые функциональные группы имеют «более важное значение» и поэтому сначала нумеруются. Кроме того, если алкоголь уже не является самой «важной» функциональной группой, молекула не является суффиксом для алкоголя.
1. Спирты горят:
2С3H7ОH + 9O2 ® 6СO2 + 8H2O
2. При действии окислителей:
a) первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
R-
-CH2-OH
(первичный спирт) --[O]®
R-
-C
(альдегид) --[O]®
R-
-C
(карбоновая к-та)
O
II
CH3-CH2-OH
O
II
CH3OH + CuO --t°® H-C
I
H
B) вторичные спирты окисляются до кетонов
CH-
-R’(вторичный спирт) --[O]®
R-
Например, диол будет называться 3, 3 пентандиола. Инфракрасная спектроскопия - это метод, используемый химиками для выяснения структурной информации об органическом соединении. Органические молекулы поглощают электромагнитное излучение в инфракрасной области и способствуют определенным колебательным состояниям. Эти колебания называются фундаментальными поглощениями, и они возникают из-за возбуждения из основного состояния в возбужденное состояние с наименьшей энергией. Затем эти моды вибрации поднимаются машиной, которая интерпретирует излучение в виде спектра.
C-
-R"(кетон)
CH3-
CH-CH2-CH3
I
OH
--K2Cr2O7,H2SO4®
CH3-
C-CH2-CH3
II
O
C) третичные спирты устойчивы к действию окислителей.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами.
1. Внутримолекулярная дегидратация приводит к образованию алкенов
CH3-CH2-OH --t°>140°C,H2SO4® CH2=CH2 + H2O
CH3
I
CH3-C-
C=CH-CH3 + H2O
I
HO
I
H
Поскольку у каждого типа ковалентной связи есть другая собственная частота вибрации, две разные молекулы никогда не будут использовать один и тот же инфракрасный спектр. Поглощение некоторых связей имеет очень отчетливые колебательные частоты. Небольшой диапазон поглощения может быть отнесен к определенному типу связи.
Его также можно использовать для различения фенолов и спиртов. Инфракрасный спектр - полезный аналитический инструмент, который используется для определения того, какие функциональные группы присутствуют, а какие нет. Ядерный магнитный резонанс - метод, используемый для идентификации органических соединений. Поскольку атомное ядро имеет вращающийся заряд из-за положительно заряженных протонов, оно может генерировать магнитное поле. Из-за этого протоны будут иметь две ориентации, β и α спиновые состояния, которые имеют разные энергии при наличии внешнего магнитного поля.
При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).
2. Межмолекулярная дегидратация даёт простые эфиры
OH + H-
-O-R -- t°,H2SO4® R-O-R(простой эфир) + H2O
O-CH2-CH3 --t°<140°C,H2SO4® CH3-CH2-O-CH2-CH3(диэтиловый эфир) + H2O
Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.
Многоатомные спирты
Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (см. "Жиры") или из пропилена по схемам:
Физические свойства
Этиленгликоль и глицерин - бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах.
CH2-OH
I
CH2-OH
Na
---®
-1/2H2
CH2-ONa
I
CH2-OH
Na
---®
-1/2H2
CH2-ONa
I
CH2-ONa
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
Так, они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
CH2-OH
2 I + Cu(OH)2(голубой осадок) ®
CH2-OH
(гликолят меди (ярко-синий раствор))
(одноатомные спирты с Cu(OH)2 не реагируют).
Глицерин легко нитруется, давая тринитроглицерин - сильное взрывчатое вещество (основа динамита):
CH2-O-
-H
HO-
-NO2
H2SO4
I
CH -O-
-H
+
HO-
-NO2
---®
CH-O-NO2
+ 3H2O
I
HO-
-NO2
При его взрыве выделяется большое количество газов и тепла:
CH2-O-NO2
I
4CH-O-NO2 ® 12CO2- + 6N2- + 10H2O + O2- + Q
I
CH2-O-NO2
Применение
Этиленгликоль применяют:
1) в качестве антифриза;
2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу);
2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.
Фенолы
орто-крезол мета-крезол пара-крезол
Получение
Фенол в промышленности получают:
1) окислением изопропилбензола (кумола) в гидроперекись с последующим разложением её серной кислотой.
2) из бензола по способу Рашига:
------®
-H2O
Химические свойства
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с p- электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С-О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О-Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.
2 OH + 2Na ® 2 ONa(фенолят натрия) + H2-
OH + NaOH « ONa + H2O
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:
3 OH + FeCl3 « O-Fe + 3 HCl
Фенолы - очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:
ONa + H2SO4 ® OH + NaHSO4
ONa + CO2 + H2O ® OH + NaHCO3
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры
O Na + Br- -CH2-CH3 ® O-CH2-CH3(этилфениловый эфир) + NaBr
И сложные эфиры
O
II O
II
O H + Cl- -C-CH3(хлорангидрид укс.кислоты) ® O- C-CH3(фениловый эфир укс.кислоты) + HCl
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
3HNO3
¬---
H2SO4
3Br2
---®
3HBr
NO2
2,4,6 - тринитро-
фенол
(пикриновая кислота)
2,4,6-трибром-
фенол
3. Гидрирование.
3H2
--®
Ni
(циклогексанол)
Применение
Фенол применяется при производстве фенолформальдегидных смол, в фармацевтической промышленности и как антисептик (карболовая кислота).
Гидрохинон (1,4-диоксибензол) - проявитель в фотографии.
Спирты
Строение
Спиртами
(или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп -ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
одноатомные
двухатомные (гликоли)
трехатомные.
| Одноатомные спирты: | Двухатомный спирт: | Трехатомный спирт: |
|
| CH 3 -OH | CH 3 CH 2 -OH | HO-CH 2 -CH 2 -OH | пропантриол-1,2,3 (глицерин) |
Одноатомные спирты
Общая формула одноатомных спиртов - R-OH.
По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
Общая формула предельных одноатомных спиртов - C n N 2 n +1 -OH.
Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C 6 H 5 -OH - гидроксобензол (фенол).
По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R-CH 2 -OH), вторичные (R-CHOH-R") и третичные (RR"R""C-OH) спирты.
| Первичный спирт: | Вторичный спирт: | Третичный спирт: |
| CH 3 CH 2 CH 2 CH 2 -OH |
| 2-метилпропанол-2 (трет -бутиловый спирт) |
C n N 2n+2 O - общая формула и предельных одноатомных спиртов, и простых эфиров.
Предельные одноатомные спирты изомерны простым эфирам - соединениям с общей формулой R-O-R".
Изомеры и гомологи

Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия.
Алгоритм составления названий одноатомных спиртов
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
Назовите соединение по алгоритму для углеводородов.
В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей:
С этим же связана и хорошая растворимость в воде низших спиртов.
Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит.
Химические свойства спиртов
C 2 H 5 OH + 3O 2 2CO 2 +3H 2 O + Q
Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства):
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
2Na + 2H-O-H 2NaOH + H
2
2Na + 2R-O-H 2RONa + H
2
С твердыми щелочами и с их растворами спирты не реагируют.
Реакции с галогеноводородами:
C 2 H 5 OH + HBr C 2 H 5 Br + H 2 O
Внутримолекулярная дегидратация (t 140 o С, образуются алкены):
C 2 H 5 OH C 2 H 4 + H 2 O
Межмолекулярная дегидратация (t o С, образуются простые эфиры):
2C 2 H 5 OH C 2 H 5 OC 2 H 5 + H 2 O
Окисление (мягкое, до альдегидов):
CH 3 CH 2 OH + CuO CH 3 -CHO + Cu + H 2 O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида).
Получение спиртов
Многоатомные спирты
Существуют и полиатомные (многоатомные) спирты , содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует заметить, что спирты, содержащие две гидроксильные группы при одном атоме углерода, неустойчивы и самопроизвольно разлагаются (подвергаются перегруппировке атомов) с образованием альдегидов и кетонов:
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения - альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол - виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид.
Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO-CH 2 -CH 2 -OH и трехатомный спирт пропантриол-1,2,3 (глицерин) HO-CH 2 -CH(OH)-CH 2 -OH.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит.

Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее.
Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na 2 .
Отдельные представители спиртов и их значение
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт - важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме - ацетальдегид - крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью - циррозу печени.
Фенолы
Фено́лы - органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца.
По числу ОН-групп различают:
одноатомные фенолы (аренолы): фенол (C 6 H 5 OH) и его гомологи;
двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C 6 H 5 -OH.
 а)
а) 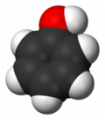 б)
б)
Шаростержневая (а) и масштабная модели молекулы фенола
Изомерия
Возможны 2 типа изомерии:
1. Изомерия положения заместителей в бензольном кольце;
2. Изомерия боковой цепи (строения алкильного радикала и числа радикалов).
В живых организмах
Фенол является окончанием боковой группы стандартной аминокислоты тирозина, и поэтому входит в состав практически каждой белковой молекулы.
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа - OH - положительным. Дипольный момент направлен в сторону бензольного кольца.
Как известно, гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях. Смещение не поделённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается в свойствах фенола.
Во-первых, повышается способность к замещению атомов водорода в орто- и пара-положениях бензольного ядра, и в результате реакций замещения обычно образуются три-замещённые производные фенола.
Во-вторых, увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства фенола :
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) - бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол - токсичное вещество, вызывает ожоги кожи, является антисептиком! 

Химические свойства
Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O-H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только со щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
C 6 H 5 OH + NaOH C 6 H 5 ONa + H 2 O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
Образуется 2,4,6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
C 6 H 5 -OH + HNO 3 (разб.) H 2 O + NO 2 -C 6 H 4 -OH (смесь орто - и пара -изомеров)
| 3HNO 3 (конц.) 3H 2 O + |
|
По второй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы):

Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
Получение фенола
Современной промышленности известно несколько способов получения фенола:
Кумольный метод получения.

Гидропероксид кумола (ГПК) получают при нормальном (без использования катализаторов) окислении воздухом кумола в каскаде барботажных колонн. А фенол и ацетон получают в ходе разложения ГПК с использованием в качестве катализатора серной кислоты.
Получение фенола путем сплавления ароматических сульфокислот со щелочами.

На феноксиды, образованные в результате сплавления ароматических сульфокислот с щелочами, оказывают воздействие сильными кислотами. В результате получаются многоатомные свободные фенолы.
Получение фенола путем воздействия на галогенбензолы:
С 6 Н 5 -Сl + 2NaOH C 6 H 5 -ONa + NaCl + Н 2 О
Фенолят натрия получают при взаимодействии гидроксида натрия и хлорбензола. Обязательным катализатором в данной реакции является давление. Далее фенолят натрия обрабатывают кислотой.
Применение фенола

Фенолы применяют в производстве различных феноло-альдегидных смол, полиамидов, полиарилатов, полиариленсульфонов, эпоксидных смол, антиоксидантов, бактерицидов и пестицидов (например, нитрафен). Алкилфенолы используют в производстве ПАВ, стабилизаторов и присадок к топливам. Двухатомные фенолы и их производные входят в состав дубителей для кожи и меха, модификаторов и стабилизаторов резин и каучуков, применяются для обработки кино- и фотоматериалов. В медицине фенолы и их производные используют в качестве антимикробных (фенол, резорцин), противовоспалительных (салол, осарсол), спазмолитических (адреналин, папаверин), жаропонижающих (аспирин, салициловая кислота), слабительных (фенолфталеин), адренолитических (мезатон), вяжущих (таннины) и других лекарственных средств, а также витаминов E и P.

