Топливные элементы на водороде. Водородные топливные элементы: от полетов «Аполлона» до автомобилей.
Топливные элементы представляют собой способ электрохимического превращения энергии водородного топлива в электричество, и единственным побочным продуктом этого процесса является вода.
Водородное топливо, используемое сейчас в топливных элементах, обычно получается из парового риформинга метана (то есть превращения углеводородов с помощью пара и тепла в метан), хотя подход может быть и более «зеленым», например электролиз воды с использованием солнечной энергии.
Нынешнее поколение топливных элементов еще не конкурирует с бензиновым двигателем. Клетки подразделяются на продолжительность работы, ремонт и холодную работу. Хранение водорода - еще одна проблема в поиске подходящего материала, который обеспечивает плотность водорода и позволяет быстро заряжать и разбавлять. Многие традиционные материалы были отклонены в качестве носителей, поскольку они не отвечают этим критериям. Однако нанонаука открывает новые возможности. Исследуются материалы с гибридной структурой, обеспечивающие многофункциональные характеристики, такие как удаление энергии водорода на поверхности и быстрое распространение атомов водорода во внутренней части.
Основными компонентами топливного элемента являются:
- анод, в котором происходит окисление водорода;
- катод, где идет восстановление кислорода;
- полимерная электролитная мембрана, через которую осуществляется транспорт протонов или гидроксид-ионов (в зависимости от среды), - она не пропускает водород и кислород;
- поля течения кислорода и водорода, которые ответственны за доставку этих газов к электроду.
Для того чтобы питать энергией, к примеру, автомобиль, несколько топливных элементов собираются в батарею, и количество энергии, поставляемое этой батареей, зависит от общей площади электродов и количества элементов в ней. Энергия в топливном элементе генерируется следующим образом: водород окисляется на аноде, и электроны от него направляются к катоду, где восстанавливается кислород. Электроны, полученные от окисления водорода на аноде, имеют более высокий химический потенциал, чем электроны, которые восстанавливают кислород на катоде. Эта разница между химическими потенциалами электронов позволяет извлекать энергию из топливных элементов.
Задача для производителей заключается в поиске источника водорода для удовлетворения потребностей экономики и не зависит от ископаемого топлива и сырья. Добыча водорода из природного газа является широко используемым и установленным процессом в количествах, достаточных для вождения автомобилей, но приводит к образованию углекислого газа. Помимо ископаемых видов топлива, возможные источники водорода включают в себя преобразование углеводов из биомассы или тепловое электролитическое или фотохимическое разделение молекул воды.
Хотя эти пути водорода являются привлекательными и потенциально жизнеспособными, они требуют прорывов в разведке материалов, катализаторов для снижения энергетических барьеров. Водород и электричество вместе представляют собой один из наиболее перспективных способов обеспечения устойчивой энергии, причем топливные элементы обеспечивают наиболее эффективное устройство для преобразования водорода и, возможно, других видов топлива в электричество.
История создания
История топливных элементов отсылает нас к 30-м годам XIX века, когда первый водородный топливный элемент был сконструирован Уильямом Р. Гроувом. Этот элемент использовал серную кислоту в качестве электролита. Гроув пытался осадить медь из водного раствора сульфата меди на железную поверхность. Он заметил, что под действием электронного тока вода распадается на водород и кислород. После этого открытия Гроув и работавший параллельно с ним Кристиан Шенбейн, химик из Университета Базеля (Швейцария), в 1839 году одновременно продемонстрировали возможность производства энергии в водородно-кислородном топливном элементе с использованием кислотного электролита. Эти первые попытки хотя и были по сути своей достаточно примитивными, но привлекли внимание нескольких их современников, включая Майкла Фарадея.
Водород и топливные элементы открывают путь для интегрированной «открытой энергетической системы», которая одновременно отвечает всем энергетическим и экологическим проблемам и обладает гибкостью при адаптации к разнообразным и летучим возобновляемым источникам энергии.
История водородного топливного элемента Топливные элементы по определению являются электрическими ячейками, которые могут непрерывно подаваться с топливом, так что электрическая мощность поддерживается на неопределенный срок. Они превращают водород или водородсодержащие топлива непосредственно в электрическую или тепловую энергию. Топливные элементы имеют много преимуществ по сравнению с тепловыми двигателями. К ним относятся высокая эффективность, тихая работа и отсутствие выбросов. Если водород производится из возобновляемых источников энергии, которые затем преобразуются в электричество, то эксплуатация объектов ВИЭ будет устойчивой.
Исследования в области топливных элементов продолжались, и в 1930-х годах Ф.Т. Бейкон внес новый компонент в щелочной топливный элемент (один из видов топливных элементов) - ионообменную мембрану для облегчения транспорта гидроксид-ионов.
Одним из самых знаменитых исторических примеров применения щелочных топливных элементов является их использование в качестве главного источника энергии во время космических полетов в программе «Аполлон».
Принцип был обнаружен случайно во время электролиза. Отключая батарею от электролизера и соединяя два электрода вместе, он контролирует возникновение обратного тока и уменьшает количество водорода и кислорода. Он назвал это устройство «газовой батареей». Он состоял из платиновых электродов, помещенных в трубки водорода и кислорода, погруженных в разбавленную серную кислоту, и газовая батарея могла генерировать напряжение около одного вольта, но из-за проблем с коррозией Электроды и нестабильность материалов, топливный элемент Гров не был практичным.
Выбор НАСА пал на них из-за их долговечности и технической устойчивости. В них использовалась гидроксидпроводящая мембрана, превосходящая по эффективности свою протонообменную сестру.
В течение почти двух веков с момента создания первого прототипа топливного элемента было проделано много работы по их усовершенствованию. В целом конечная энергия, получаемая от топливного элемента, находится в зависимости от кинетики окислительно-восстановительной реакции, внутреннего сопротивления элемента и переноса масс реагирующих газов и ионов на каталитически активные компоненты. За многие годы было сделано много улучшений изначальной идеи, таких как:
Он использует щелочные электролиты вместо разбавленной серной кислоты. Электроды изготовлены из пористой спеченной никелевой пыли, так что газы контактируют с водным электролитом с другой стороны электрода. Это значительно увеличивает контакты между электродами, газами и электролитами, что увеличивает мощность топливных элементов. Кроме того, использование никеля значительно дешевле платины. Обеспечивается топливными элементами, а те же топливные элементы обеспечивают питьевую воду для экипажа. Введение в водородную топливную ячейку.
1) замена платиновых проводов на электроды на основе углерода с наночастицами платины; 2) изобретение мембран высокой проводимости и селективности, таких как Nafion, для облегчения ионного транспорта; 3) совмещение каталитического слоя, например наночастиц платины, распределенных по углеродной основе, с ионообменными мембранами, в результате чего получился мембранно-электродный блок с минимальным внутренним сопротивлением; 4) использование и оптимизация полей течения для доставки водорода и кислорода на каталитическую поверхность, вместо того чтобы напрямую разбавлять их в растворе.
Водородный топливный элемент работает как аккумулятор. Он имеет два электрода, один анод и один катод, разделенные мембраной. Кислород проходит через один электрод и водород через другой. Водород реагирует с анодным катализатором, который превращает водород в отрицательно заряженные электроны и положительно заряженные ионы. В водородном топливном элементе химическая реакция представляет собой анодное окисление и катодное восстановление. Электролит в полимерной мембране является чистой кислотой. Он разбавляется водой, чтобы обеспечить перенос ионов.
Эти и другие улучшения в конечном итоге позволили получить технологию, достаточно эффективную, чтобы ее можно было использовать в автомобилях, таких как Toyota Mirai.
Топливные элементы с гидроксидобменными мембранами
В Университете Делавэра проводятся исследования по разработке топливных элементов с гидроксидобменными мембранами - HEMFCs (hydroxide exchange membrane fuel cells). Топливные элементы с гидроксидобменными мембранами вместо протонообменных - PEMFCs (proton exchange membrane fuel cells) - меньше сталкиваются с одной из больших проблем PEMFCs - проблемой стабильности катализатора, поскольку намного большее количество катализаторов на основе неблагородных металлов стабильно в щелочной среде, чем в кислой. Стабильность катализаторов в щелочных растворах выше благодаря тому, что растворение металлов выделяет больше энергии при низком pH, нежели при высоком. Большая часть работы в этой лаборатории также посвящена разработке новых анодных и катодных катализаторов реакций окисления водорода и восстановления кислорода для еще более эффективного их ускорения. В дополнение к этому лабораторией разрабатываются новые гидроксидобменные мембраны, так как проводимость и долговечность таких мембран еще предстоит улучшить, для того чтобы они могли составить конкуренцию протонообменным.
На аноде молекулы водорода сначала вступают в контакт с платиновым катализатором на поверхности анода. После разделения молекул водорода окисление может продолжаться. Каждый атом водорода высвобождает свой электрон, который начинает двигаться по внешнему напряжению катода.
На катоде молекулы кислорода контактируют с катализатором поверхности платинового электрода. Кислородные молекулы разлагаются и связываются с поверхностью платины. Каждый атом кислорода затем покидает платиновый катализатор путем связывания с двумя электронами и двумя протонами с образованием молекулы воды. Электронный поток выходит из ячейки для использования в качестве электрической энергии. Ионы водорода проходят через электролит мембраны к катоду, где они объединяются с кислородом и электронами для получения воды.
Поиск новых катализаторов
Причина потерь от перенапряжения в реакции восстановления кислорода объясняется отношениями линейного масштаба между промежуточными продуктами этой реакции. В традиционном четырехэлектронном механизме этой реакции кислород последовательно восстанавливается, создавая промежуточные продукты - OOH*, O* и OH*, чтобы в конечном итоге образовать воду (H2O) на каталитической поверхности. Поскольку энергии адсорбции промежуточных продуктов у отдельного катализатора сильно коррелируют друг с другом, пока еще не найдено ни одного катализатора, который хотя бы в теории не имел бы потерь от перенапряжения. Несмотря на то, что скорость этой реакции низка, замена кислотной среды на щелочную, как, например, в HEMFC, на нее не особенно влияет. Однако скорость реакции окисления водорода уменьшается почти в два раза, и этот факт мотивирует исследования, направленные на нахождение причины этого уменьшения и на обнаружение новых катализаторов.
В отличие от батарей, топливный элемент никогда не истощается. Водород и кислород можно объединить в топливный элемент для производства электрической энергии. Топливный элемент использует химическую реакцию для обеспечения внешнего напряжения, такого как аккумулятор, но отличается тем, что топливо постоянно подается в виде водорода и кислорода. Он может производить более эффективную электроэнергию, чем просто сжигать водород для получения тепла для питания генератора. Единственным продуктом сжигания является вода, поэтому водородный топливный элемент является экологически чистым.
Преимущества топливных элементов
В противовес углеводородному топливу топливные элементы более, если не совершенно, безопасны для окружающей среды и не производят парниковых газов в результате своей деятельности. Более того, их топливо (водород) в принципе является возобновляемым, поскольку его можно получить путем гидролиза воды. Таким образом, водородные топливные элементы в будущем обещают стать полноправной частью процесса производства энергии, в котором энергия солнца и ветра используется для производства водородного топлива, которое затем используется в топливном элементе для производства воды. Таким образом, цикл замыкается, и не оставляется никакого углеродного следа.
Добыча, хранение и транспортировка водорода. Одной из наиболее интересных проблем, связанных с водородной экономикой, является водород. Ископаемое топливо извлекается из огромных отложений в земле, хранится и затем сжигается как источник энергии. В условиях водородной экономики не будет склада, из которого можно взять водород. Он должен быть извлечен и использован для создания энергии в реальном времени.
Существует два возможных источника водорода: электролиз воды и реформирование ископаемого топлива. При электролизе воды электричеством молекулы воды разделяются на чистый водород и кислород. Одно из преимуществ этого процесса заключается в том, что он может идти куда угодно. Например, у вас может быть ячейка в вашем гараже для производства водорода из водопроводной воды, и вы можете управлять автомобилем этим водородом.
В отличие от перезаряжаемых батарей, топливные элементы имеют то преимущество, что их не надо перезаряжать - они могут сразу начать поставлять энергию, как только она понадобится. То есть если их применять, например, в области средств передвижения, то со стороны потребителя перемен почти не будет. В отличие же от солнечной энергии и энергии ветра топливные элементы могут производить энергию постоянно и куда меньше зависят от внешних условий. В свою очередь, геотермальная энергия доступна только в определенных географических областях, в то время как топливные элементы опять же не имеют такой проблемы.
Реформа ископаемого топлива использует тот факт, что нефть и природный газ содержат углеводороды - молекулы, состоящие из водорода и углерода. Используя устройство, называемое топливным процессором или риформинг-установкой, вы можете разделить водород и углерод. Но тогда остатки углерода выбрасываются в атмосферу в виде двуокиси углерода. Использование ископаемого топлива в качестве источника водорода снижает загрязнение воздуха, но не решает проблему парниковых газов или проблемы зависимости. Однако второй вариант может стать хорошим временным шагом на пути к водородной экономике.
Водородные топливные элементы - одни из наиболее многообещающих альтернативных источников энергии благодаря своей портативности и гибкости в плане масштаба.
Сложность хранения водорода
Помимо проблем с недостатками нынешних мембран и катализаторов, другие технические трудности для топливных элементов связаны с хранением и транспортом водородного топлива. Водород обладает очень низкой удельной энергией на единицу объема (количеством энергии, которая содержится в единице объема при данной температуре и давлении), и потому он должен храниться под очень высоким давлением, чтобы его можно было использовать в средствах передвижения. В противном случае размер контейнера для хранения необходимого количества топлива будет невозможно большим. Из-за этих ограничений хранения водорода предпринимались попытки найти способы получения водорода из чего-то кроме газообразной его формы, как, к примеру, в металлогидридных топливных элементах. Тем не менее нынешние потребительские применения топливных элементов, такие как Toyota Mirai, используют сверхкритический водород (водород, находящийся в условиях температуры выше 33 К и давления выше 13,3 атмосфер, то есть выше критических значений), и сейчас это наиболее удобный вариант.
Но ядро реальной водородной экономики должно быть первым вариантом. Чтобы иметь чистый источник энергии, водород должен быть произведен из возобновляемых источников, а не из ископаемого топлива. Существует несколько способов создания не ископаемого электричества: ядерного, гидроэнергетического, ветрового и солнечного парков, геотермальных источников и когенерации. Их будущее развитие станет важной предпосылкой для водородной экономики.
После уточнения и более дешевой технологии топливных элементов, работающей на водороде, можно заменить бензиновые двигатели внутренним сгоранием. Однако для этого потребуется примерно двукратное увеличение генерируемой электроэнергии. Другими словами, количество электростанций необходимо удвоить, а все ископаемые виды топлива заменить.
Перспективы области
Из-за существующих технических трудностей и проблем получения водорода из воды при помощи солнечной энергии в ближайшем будущем исследования, скорее всего, будут нацелены в основном на поиск альтернативных источников водорода. Одна популярная идея состоит в том, чтобы использовать аммиак (нитрид водорода) напрямую в топливном элементе вместо водорода или чтобы получать водород из аммиака. Причина этого - меньшая требовательность аммиака по части давления, что делает его более удобным для хранения и перемещения. Помимо того, аммиак привлекателен как источник водорода потому, что в нем нет углерода. Благодаря этому решается проблема отравления катализатора из-за некоторого количества СО в водороде, произведенном из метана.
Еще одной проблемой с введением чистого водорода является его хранение и транспортировка. Водород - это легкий газ, с которым работать нелегко, как бензин. Сжатие газа требует энергии, а сжатый водород содержит гораздо меньше энергии, чем такое же количество бензина. Например, водород можно хранить в твердом состоянии в химическом веществе, называемом боргидридом натрия. Это недавно появившаяся технология, которая в случае успеха позволила бы создать водородные станции и транспортную инфраструктуру.
Эффективность водородных топливных элементов. Существует множество факторов, влияющих на эффективность использования топливных элементов водорода. Напряжение, создаваемое ячейкой, является эффективным критерием его электрической эффективности. Чем ниже напряжение, тем ниже электрический КПД и большая часть химической энергии при образовании воды становится теплом. Основными причинами, способствующими снижению стресса, являются. Потеря активации - потеря энергии, необходимая для инициирования реакции.
В будущем топливные элементы могут найти широкое применение в области технологий средств передвижения и распределенного производства энергии, например, в жилых районах. Несмотря на то, что в данный момент использование топливных элементов в качестве главного источника энергии требует больших денежных средств, в случае обнаружения более дешевых и эффективных катализаторов, стабильных мембран с высокой проводимостью и альтернативных источников водорода водородные топливные элементы могут приобрести высокую экономическую привлекательность.
Это связано с катализатором. Чем лучше, тем меньше энергии активации. Платиновые формы являются отличным катализатором, но также требуются лучшие материалы. Переключение топлива и внутреннего напряжения. Это результат топлива, которое проходит непосредственно через электролит от анода к катоду, не выделяя электроны во внешнем напряжении, тем самым снижая эффективность топливных элементов.
Они являются результатом объединения сопротивлений отдельных компонентов топливных элементов. Это включает в себя сопротивление материала электрода, электролитической мембраны и сопротивления межсоединения. Эти потери связаны с уменьшением концентрации водорода и кислорода в электродах. После реакции свежие газы следует вводить немедленно. При накоплении воды в катоде, особенно при высоких напряжениях, катализатор может засориться, а кислород ограничен. Вот почему важно удалить лишнюю воду.
Топливный элемент – это электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне - в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.

Преимущества топливных элементов Многие из них являются потенциальными преимуществами топливных элементов. Прежде всего, они очень эффективны. Они превращают водород и кислород непосредственно в электричество и воду без сгорания в этом процессе. Если топливные элементы питаются от чистого водорода, они могут быть эффективными на 80%. Если исходным топливом является водород, не будет никаких вредных выбросов из самой ячейки, а только чистое производство воды. Топливные элементы также тихие. Сама ячейка не имеет движущихся частей, хотя в системе могут быть насосы и вентиляторы.
Рис. 1. Некоторые топливные элементы
Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные процессы горения, идущие с большими потерями. Они в результате химической реакции преобразовывают водород и кислород в электричество. В результате этого процесса образуется вода и выделяется большое количество теплоты. Топливный элемент очень похож на аккумулятор, который можно зарядить и затем использовать накопленную электрическую энергию. Изобретателем топливного элемента считают Вильяма Р. Грува, который изобрел его еще в 1839 году. В этом топливном элементе в качестве электролита использовался раствор серной кислоты, а в качестве топлива - водород, который соединялся с кислородом в среде окислителя. До недавнего времени топливные элементы использовались только в лабораториях и на космических аппаратах.

Рис. 2.
В отличие от других генераторов электроэнергии, таких как двигатели внутреннего сгорания или турбины, работающие на газе, угле, мазуте и пр., топливные элементы не сжигают топливо. Это означает отсутствие шумных роторов высокого давления, громкого шума при выхлопе, вибраций. Топливные элементы вырабатывают электричество путем бесшумной электрохимической реакции. Другой особенностью топливных элементов является то, что они преобразуют химическую энергию топлива напрямую в электричество, теплоту и воду.
Топливные элементы высокоэффективны и не производят большого количества парниковых газов, таких как углекислый газ, метан и оксид азота. Единственным продуктом выброса при работе топливных элементов являются вода в виде пара и небольшое количество углекислого газа, который вообще не выделяется, если в качестве топлива используется чистый водород. Топливные элементы собираются в сборки, а затем в отдельные функциональные модули.
Топливные элементы не имеют движущихся частей (по крайней мере, внутри самого элемента), и поэтому они не подчиняются закону Карно. То есть они будут иметь больший, чем 50%, КПД и особенно эффективны при малых нагрузках. Таким образом, автомобили с топливными элементами могут стать (и уже доказали это) более экономичными, чем обычные автомобили в реальных условиях движения.
Топливный элемент обеспечивает выработку электрического тока постоянного напряжения, который может использоваться для привода в действие электродвигателя, приборов системы освещения и других электрических систем в автомобиле.
Есть несколько типов топливных элементов, различающихся используемыми химическими процессами. Топливные элементы обычно классифицируются по типу используемого в них электролита.
Некоторые типы топливных элементов являются перспективными для применения их в качестве силовых установок электростанций, а другие - для портативных устройств или для привода автомобилей.
1. Щелочные топливные элементы (ЩТЭ)
Щелочной топливный элемент - это один из самых первых разработанных элементов. Щелочные топливные элементы (ЩТЭ) – одна из наиболее изученных технологий, используемая с середины 60-х годов ХХ века агентством НАСА в программах «Аполлон» и «Спейс Шаттл». На борту этих космических кораблей топливные элементы производят электрическую энергию и питьевую воду.
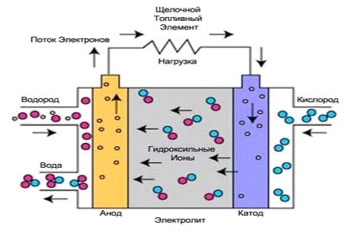
Рис. 3.
Щелочные топливные элементы – одни из самых эффективных элементов, используемых для генерации электричества, эффективность выработки электроэнергии доходит до 70%.
В щелочных топливных элементах используется электролит, то есть водный раствор гидроксида калия, содержащийся в пористой стабилизированной матрице. Концентрация гидроксида калия может меняться в зависимости от рабочей температуры топливного элемента, диапазон которой варьируется от 65°С до 220°С. Носителем заряда в ЩТЭ является гидроксильный ион (ОН-), движущийся от катода к аноду, где он вступает в реакцию с водородом, производя воду и электроны. Вода, полученная на аноде, движется обратно к катоду, снова генерируя там гидроксильные ионы. В результате этого ряда реакций, проходящих в топливном элементе, производится электричество и, как побочный продукт, теплоту:
Реакция на аноде: 2H2 + 4OH- => 4H2O + 4e
Реакция на катоде: O2 + 2H2O + 4e- => 4OH
Общая реакция системы: 2H2 + O2 => 2H2O
Достоинством ЩТЭ является то, что эти топливные элементы - самые дешевые в производстве, поскольку катализатором, который необходим на электродах, может быть любое из веществ, более дешевых, чем те, что используют в качестве катализаторов для других топливных элементов. Кроме того, ЩТЭ работают при относительно низкой температуре и являются одними из самых эффективных.
Одна из характерных особенностей ЩТЭ – высокая чувствительность к CO2, который может содержаться в топливе или воздухе. CO2 вступает в реакцию с электролитом, быстро отравляет его, и сильно снижает эффективность топливного элемента. Поэтому использование ЩТЭ ограничено закрытыми пространствами, такими как космические и подводные аппараты, они работают на чистом водороде и кислороде.
2. Топливные элементы на расплаве карбоната (РКТЭ)
Топливные элементы с расплавленным карбонатным электролитом являются высокотемпературными топливными элементами. Высокая рабочая температура позволяет непосредственно использовать природный газ без топливного процессора и топливного газа с низкой теплотворной способностью топлива производственных процессов и из других источников. Данный процесс разработан в середине 60-х годов ХХ века. С того времени была улучшена технология производства, рабочие показатели и надежность.

Рис. 4.
Работа РКТЭ отличается от других топливных элементов. Данные элементы используют электролит из смеси расплавленных карбонатных солей. В настоящее время применяется два типа смесей: карбонат лития и карбонат калия или карбонат лития и карбонат натрия. Для расплавки карбонатных солей и достижения высокой степени подвижности ионов в электролите, работа топливных элементов с расплавленным карбонатным электролитом происходит при высоких температурах (650°C). КПД варьируется в пределах 60-80%.
При нагреве до температуры 650°C соли становятся проводником для ионов карбоната (CO32-). Эти ионы проходят от катода на анод, где происходит объединение с водородом с образованием воды, диоксида углерода и свободных электронов. Данные электроны направляются по внешней электрической цепи обратно на катод, при этом генерируется электрический ток, а в качестве побочного продукта – теплота.
Реакция на аноде: CO32- + H2 => H2O + CO2 + 2e
Реакция на катоде: CO2 + 1/2O2 + 2e- => CO32-
Общая реакция элемента: H2(g) + 1/2O2(g) + CO2(катод) => H2O(g) + CO2(анод)
Высокие рабочие температуры топливных элементов с расплавленным карбонатным электролитом имеют определенные преимущества. Преимущество - возможность применять стандартные материалы (листовую нержавеющую сталь и никелевый катализатор на электродах). Побочную теплоту можно использовать для получения пара высокого давления. Высокие температуры реакции в электролите также имеют свои преимущества. Применение высоких температур требует большого времени для достижения оптимальных рабочих условий, при этом система медленнее реагирует на изменение расхода энергии. Данные характеристики позволяют использовать установки на топливных элементах с расплавленным карбонатным электролитом в условиях постоянной мощности. Высокие температуры препятствуют повреждению топливного элемента окисью углерода, «отравлению» и пр.
Топливные элементы с расплавленным карбонатным электролитом подходят для использования в больших стационарных установках. Промышленно выпускаются теплоэнергетические установки с выходной электрической мощностью 2,8 МВт. Разрабатываются установки с выходной мощностью до 100 МВт.
3. Топливные элементы на основе фосфорной кислоты (ФКТЭ)
Топливные элементы на основе фосфорной (ортофосфорной) кислоты стали первыми топливными элементами для коммерческого использования. Данный процесс был разработан в середине 60-х годов ХХ, испытания проводились с 70-х годов ХХ века. В итоге были увеличены стабильность и рабочие показатели и снижена стоимость.

Рис. 5.
Топливные элементы на основе фосфорной (ортофосфорной) кислоты используют электролит на основе ортофосфорной кислоты (H3PO4) с концентрацией до 100%. Ионная проводимость ортофосфорной кислоты является низкой при низких температурах, поэтому эти топливные элементы используются при температурах до 150-220 °C.
Носителем заряда в топливных элементах данного типа является водород (H+, протон). Схожий процесс происходит в топливных элементах с мембраной обмена протонов (МОПТЭ), в которых водород, подводимый к аноду, разделяется на протоны и электроны. Протоны проходят по электролиту и объединяются с кислородом, получаемым из воздуха, на катоде с образованием воды. Электроны направляются по внешней электрической цепи, при этом генерируется электрический ток. Ниже представлены реакции, в результате которых генерируется электрический ток и тепло.
Реакция на аноде: 2H2 => 4H+ + 4e
Реакция на катоде: O2(g) + 4H+ + 4e- => 2H2O
Общая реакция элемента: 2H2 + O2 => 2H2O
КПД топливных элементов на основе фосфорной (ортофосфорной) кислоты составляет более 40% при генерации электрической энергии. При комбинированном производстве тепловой и электрической энергии, общий КПД составляет около 85%. Помимо этого, учитывая рабочие температуры, побочную теплоту можно быть использовать для нагрева воды и генерации пара атмосферного давления.
Высокая производительность теплоэнергетических установок на топливных элементах на основе фосфорной (ортофосфорной) кислоты при комбинированном производстве тепловой и электрической энергии является одним из преимуществ данного вида топливных элементов. В установках используется окись углерода с концентрацией около 1,5%, что значительно расширяет возможность выбора топлива. Простая конструкция, низкая степень летучести электролита и повышенная стабильность - также преимущества таких топливных элементов.
Промышленно выпускаются теплоэнергетические установки с выходной электрической мощностью до 400 кВт. Установки мощностью 11 МВт прошли соответствующие испытания. Разрабатываются установки с выходной мощностью до 100 МВт.
4. Топливные элементы с мембраной обмена протонов (МОПТЭ)
Топливные элементы с мембраной обмена протонов считаются самым лучшим типом топливных элементов для генерации питания транспортных средств, которое способно заменить бензиновые и дизельные двигатели внутреннего сгорания. Эти топливные элементы впервые использованы НАСА для программы «Джемини». Разработаны и показаны установки на МОПТЭ мощностью от 1Вт до 2 кВт.

Рис. 6.
Электролитом в этих топливных элементах является твердая полимерная мембрана (тонкая пластмассовая пленка). При пропитывании водой этот полимер пропускает протоны, но не проводит электроны.
Топливом является водород, а носителем заряда – ион водорода (протон). На аноде молекула водорода разделяется на ион водорода (протон) и электроны. Ионы водорода проходят сквозь электролит к катоду, а электроны перемещаются по внешнему кругу и производят электрическую энергию. Кислород, который берется из воздуха, подается к катоду и соединяется с электронами и ионами водорода, образуя воду. На электродах происходят следующие реакции: Реакция на аноде: 2H2 + 4OH- => 4H2O + 4eРеакция на катоде: O2 + 2H2O + 4e- => 4OHОбщая реакция элемента: 2H2 + O2 => 2H2O По сравнению с другими типами топливных элементов, топливные элементы с мембраной обмена протонов производят больше энергии при заданном объеме или весе топливного элемента. Эта особенность позволяет им быть компактными и легкими. К тому же рабочая температура – менее 100°C, что позволяет быстро начать эксплуатацию. Эти характеристики, а также возможность быстро изменить выход энергии – лишь некоторые, делающие эти топливные элементы первым кандидатом для использования в транспортных средствах.
Другое преимущество в том, что электролитом является твердое, а не жидкое вещество. Удержать газы на катоде и аноде легче с помощью твердого электролита, поэтому такие топливные элементы более дешевы при производстве. При применении твердого электролита нет таких трудностей, как ориентация, и меньше проблем из-за появления коррозии, что повышает долговечность элемента и его компонентов.
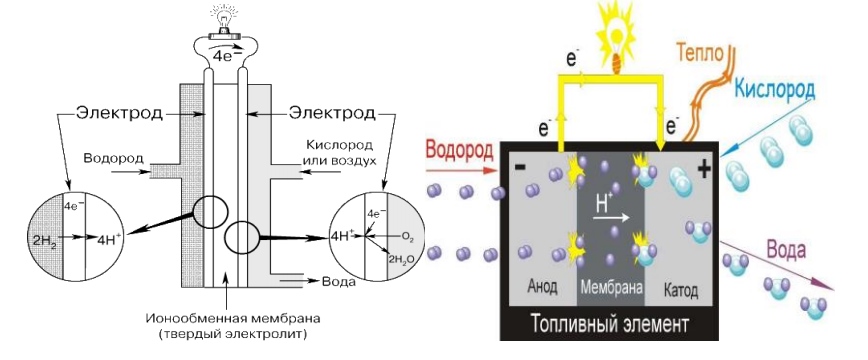
Рис. 7.
5. Твердооксидные топливные элементы (ТОТЭ)
Твердооксидные топливные элементы являются топливными элементами с самой высокой рабочей температурой. Рабочая температура может варьироваться от 600°C до 1000°C, что позволяет использовать различные типы топлива без специальной предварительной обработки. Для работы с такими высокими температурами используемый электролит представляет собой тонкий твердый оксид металла на керамической основе, часто сплав иттрия и циркония, который является проводником ионов кислорода (О2-). Технология использования твердооксидных топливных элементов развивается с конца 50-х годов ХХ века и имеет две конфигурации: плоскостную и трубчатую.
Твердый электролит обеспечивает герметичный переход газа от одного электрода к другому, в то время как жидкие электролиты расположены в пористой подложке. Носителем заряда в топливных элементах данного типа является ион кислорода (О2-). На катоде происходит разделение молекул кислорода из воздуха на ион кислорода и четыре электрона. Ионы кислорода проходят по электролиту и объединяются с водородом, при этом образуется четыре свободных электрона. Электроны направляются по внешней электрической цепи, при этом генерируется электрический ток и побочная теплота.

Рис. 8.
Реакция на аноде: 2H2 + 2O2- => 2H2O + 4e
Реакция на катоде: O2 + 4e- => 2O2-
Общая реакция элемента: 2H2 + O2 => 2H2O
КПД производства электрической энергии - самый высокий из всех топливных элементов – около 60%. Помимо этого, высокие рабочие температуры позволяют осуществлять комбинированное производство тепловой и электрической энергии для генерации пара высокого давления. Комбинирование высокотемпературного топливного элемента с турбиной позволяет создать гибридный топливный элемент для повышения КПД генерирования электрической энергии до 70%.
Твердооксидные топливные элементы работают при очень высоких температурах (600°C-1000°C), в результате чего требуется значительное время для достижения оптимальных рабочих условий, при этом система медленнее реагирует на изменение расхода энергии. При таких высоких рабочих температурах не требуется преобразователь для восстановления водорода из топлива, что позволяет теплоэнергетической установке работать с относительно нечистым топливом, полученным в результате газификации угля или отработанных газов и т.п. Также данный топливный элемент превосходно подходит для работы с высокой мощностью, включая промышленные и крупные центральные электростанции. Промышленно выпускаются модули с выходной электрической мощностью 100 кВт.
6. Топливные элементы с прямым окислением метанола (ПОМТЭ)
Топливные элементы с прямым окислением метанола успешно применяют в области питания мобильных телефонов, ноутбуков, а также для создания переносных источников электроэнергии, на что и нацелено будущее применение таких элементов.
Устройство топливных элементов с прямым окислением метанола схоже с устройством топливных элементов с мембраной обмена протонов (МОПТЭ), т.е. в качестве электролита используется полимер, а в качестве носителя заряда – ион водорода (протон). Но жидкий метанол (CH3OH) окисляется при наличии воды на аноде с выделением СО2, ионов водорода и электронов, которые направляются по внешней электрической цепи, при этом генерируется электрический ток. Ионы водорода проходят по электролиту и вступает в реакцию с кислородом из воздуха и электронами, поступающих с внешней цепи, с образованием воды на аноде.
Реакция на аноде: CH3OH + H2O => CO2 + 6H+ + 6eРеакция на катоде: 3/2O2 + 6H+ + 6e- => 3H2O Общая реакция элемента: CH3OH + 3/2O2 => CO2 + 2H2O Разработка таких топливных элементов велась с начала90-х годов ХХ века и были увеличены их удельная мощность и КПД до 40%.
Были проведены испытания данных элементов в температурном диапазоне 50-120°C. Из-за низких рабочих температур и отсутствия необходимости использовать преобразователь такие топливные элементы являются лучшим кандидатом для применения как в мобильных телефонах и других товарах широкого потребления, так и в двигателях автомобилей. Их достоинство также - небольшие габариты.
7. Полимерные электролитные топливные элементы (ПЭТЭ)

В случае полимерных электролитных топливных элементов полимерная мембрана состоит из полимерных волокон с водными областями, в которых существует проводимость ионов воды H2O+ (протон, красный) присоединяется к молекуле воды. Молекулы воды представляют проблему изза медленного ионного обмена. Поэтому требуется высокая концентрация воды как в топливе, так и на выпускных электродах, что ограничивает рабочую температуру 100°С.
8. Твердокислотные топливные элементы (ТКТЭ)

В твердокислотных топливных элементах электролит (CsHSO4) не содержит воды. Рабочая температура поэтому составляет 100-300°С. Вращение оксианионов SO42-позволяет протонам (красный) перемещаться так, как показано на рисунке. Как правило, твердокислотный топливный элемент представляет собой бутерброд, в котором очень тонкий слой твердокислотного компаунда располагается между двумя плотно сжатыми электродами, чтобы обеспечить хороший контакт. При нагреве органический компонент испаряется, выходя через поры в электродах, сохраняя способность многочисленных контактов между топливом (или кислородом на другом конце элементы), электролитом и электродами.

Рис. 9.
9. Сравнение важнейших характеристик топливных элементов
Тип топливного элемента | Рабочая температура | Эффективность выработки электроэнергии | Тип топлива | Область применения |
Средние и большие установки |
||||
Чистый водород | установки |
|||
Чистый водород | Малые установки |
|||
Большинство видов углеводородного топлива | Малые, средние и большие установки |
|||
Переносные установки |
||||
Чистый водород | Космические исследова |
|||
Чистый водород | Малые установки |

Рис. 10.
10. Использование топливных элементов в автомобилях

Рис. 11.


Рис. 12.

