Получение свойства и применение одноатомных предельных спиртов. Предельные одноатомные спирты, их строение, свойства. Применение и получение этилового спирта
Спиртами называются производные углеводородов, содержащие одну или несколько групп -ОН, называемую гидроксильной группой или гидроксилом.
Спирты классифицируют:
1. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами), трехатомные (с тремя гидроксилами) и многоатомные.
Таким образом, равновесие реакции от фенола до феноксида будет предпочтительнее действовать в прямом направлении. Влияние заместителя на кислотное поведение 55 Кислотная прочность фенола в значительной степени осуществляется заместителями. Группы, такие как нитро, хлор, циано и т.д. Усиливают кислотное поведение, тогда как группы, такие как алкил, уменьшают его. Именно по этой причине нитрофенол является более сильной кислотой по сравнению с крезолами. Электронные диаграммы приводят к большей стабилизации феноксидного иона.
Электронно-лизинговые группы деформируют феноксид-ион, усиливая отрицательный заряд. Феноксид натрия при обработке алкилгалогенидами образует фенольные эфиры. Смешанный эфир можно также получить путем пропускания смешанных паров фенола и некоторого спирта над нагретым оксидом алюминия или торией. Фенол реагирует с хлорангидридами кислот и ангидридами кислот с образованием соответствующих эфиров. Атом водорода с гидроксильной группой заменен соответствующей ацильной группой. Низкая температура благоприятствует п-изомеру, тогда как высокая температура способствует о-изомеру.
Подобно предельным углеводородам, одноатомные спирты образуют закономерно построенный ряд гомологов:
Как и в других гомологических рядах, каждый член ряда спиртов отличается по составу от предыдущего и последующего членов на гомологическую разность (-СН 2 -).
2.
В зависимости от того, при каком атоме
углерода находится гидроксил,
различают первичные, вторичные и
третичные спирты. В молекулах первичных
спиртов содержится группа -СН 2 ОН,
связанная с одним радикалом или с атомом
водорода у метанола (гидроксил при
первичном атоме углерода). Для вторичных
спиртов характерна группа >СНОН,
связанная с двумя радикалами (гидроксил
при вторичном атоме углерода). В молекулах
третичных спиртов имеется группа
>С-ОН, связанная с тремя радикалами
(гидроксил при третичном атоме углерода).
Обозначая радикал через R,
можно написать формулы этих спиртов
в общем виде:
Пара-продукт, как представляется, подвергается кинетическому контролю, тогда как орто-продукт термодинамически контролируется. Возможно, из-за стерических затруднений ортоизомер не может образовываться при низких температурах. Механизм перестройки Фриза: Механизм перестановки Фриза является вопросом большого разногласия. Было предложено несколько механизмов, но точный механизм до сих пор не полностью разработан. Наиболее распространенным механизмом были Огата и Табучи. Они предполагают внутримолекулярную миграцию ацетильной группы как в орто - и парапозицию, так и с нормальным комплексом.
В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется суффикс -ол. При наличии в соединении более старших функций гидроксильная группа обозначается префиксом гидрокси- (в русском языке часто используется префикс окси-). В качестве основной цепи выбирается наиболее длинная неразветвленная цепь углеродных атомов, в состав которой входит атом углерода, связанный с гидроксильной группой; если соединение является ненасыщенным, то в эту цепь включается также и кратная связь. Следует заметить, что при определении начала нумерации гидроксильная функция обычно имеет преимущество перед галогеном, двойной связью и алкилом, следовательно, нумерацию начинают с того конца цепи, ближе к которому расположена гидроксильная группа:
Эта аналогичная реакция перегруппировки, катализируемая светом, называется перестройкой фотофайлов. При восстановлении водородом при 160 ° С в присутствии мелкодисперсного никеля он образует циклогексанол. Фенол дает эту реакцию, образуя орто - и парадививативы. Фенол соединяется с бензолом диазония хлорида в слабощелочных растворах, образуя азодид. Салициловая кислота. Феноксид натрия. Салицилат натрия. Также получают небольшое количество п-изомера. Если используется калиевая соль, основным продуктом является о-изомер.
Перегруппировка Клайзена Перегруппировка Клайзена является примером перициклических реакций и относится к категории сигматропической перегруппировки. Он включает внутримолекулярную термическую конверсию аллилариловых эфиров в аллилфенолы. Аллильная группа мигрирует из эфирного кислорода в кольцевой орто. Когда оба орто-положения блокируются, миграция происходит в соответствующем пара-положении. Перегруппировка строго внутримолекулярна, и механизм представляет собой согласованный перициклический-сигматропический сдвиг.

Простейшие спирты называют по радикалам, с которыми соединена гидроксильная группа: (СН 3) 2 СНОН - изопропиловый спирт, (СН 3) 3 СОН - трет-бутиловый спирт.
Часто употребляется рациональная номенклатура спиртов. Согласно этой номенклатуре, спирты рассматриваются как производные метилового спирта - карбинола:
Реакция протекает через циклическое шестичленное переходное состояние, в котором разрыв кислород-аллильной связи синхронен с образованием углерод-углеродной связи в ортоположении. Реакция обычно применима к фенолам, фенольным эфирам и некоторым реакционноспособным гетероциклическим соединениям, таким как пирол. Таким образом, реакция Гаттермана является частным случаем реакции Хоэша. Реакция нитрозола Либермана. При нагревании фенола с концентрированной серной кислотой и нитритом натрия получается зеленовато-синий цвет.
Когда фенол нагревается фталевым ангидридом в присутствии немного концентрированной серной кислоты, происходит конденсация, образующая фенолфталеин. Фенол легко конденсируется с формальдегидом при низкой температуре и в присутствии разбавленной кислоты или щелочи. При производстве бакелитовых пластиков. При изготовлении пикриновой кислоты. При производстве таких лекарств, как салол, аспирин, салициловая кислота и т.д. 67 Структура эфиров. Номенклатура. Эфиры обычно называются добавлением слова «эфир» после названий алкильных групп, связанных с атомом кислорода.
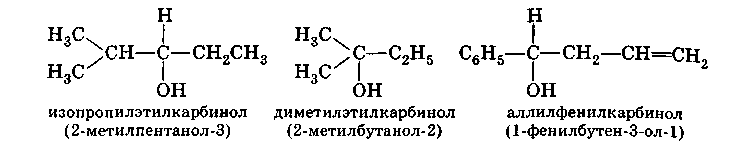
Эта система удобна в тех случаях, когда название радикала является простым и легко конструируемым.
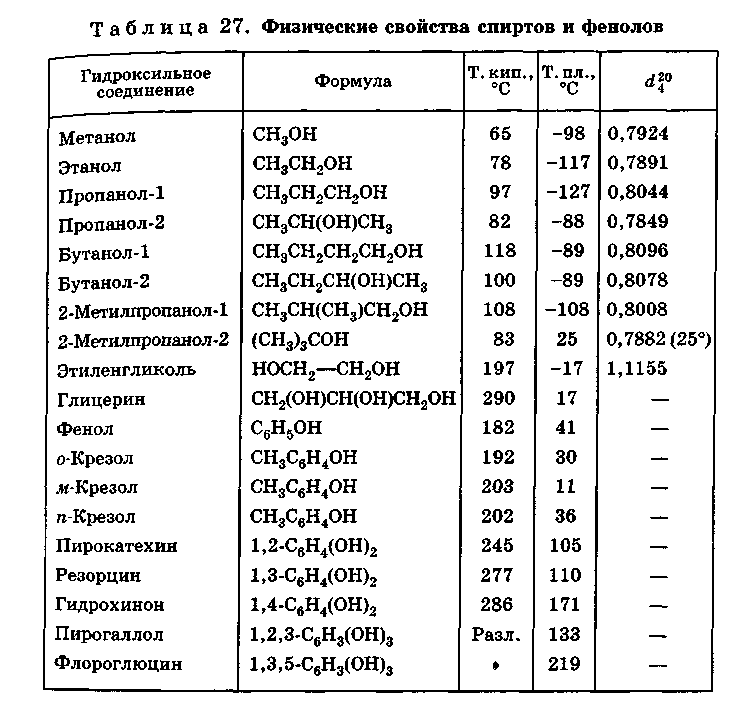
2. Физические свойства спиртов
Спирты имеют более высокие температуры кипения и значительно менее летучи, имеют более высокие температуры плавления и лучше растворимы в воде, чем соответствующие углеводороды; однако различие уменьшается с ростом молекулярной массы.
Для обозначения простого эфира упоминается только название алкильной группы. В случае несимметричных алифатических эфиров два алкила называются в порядке возрастания количества атомов углерода. Эпоксиды представляют собой циклические трехчленные простые эфиры, обычно образующиеся при окислении пероксиоксидазы соответствующих алкенов. Циклогексеновый оксид. Один систематический метод обозначения эпоксида - это название остальной части молекулы и использовать термин «оксид», эпоксид в качестве заместителя, дающего число двух атомов углерода, связанных с эпоксидным кислородом.
Разница в физических свойствах связана с высокой полярностью гидроксильной группы, которая приводит к ассоциации молекул спирта за счет водородной связи:
Таким образом, более высокие температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего требуется дополнительная энергия. С другой стороны, такого типа ассоциация приводит как бы к увеличению молекулярной массы, что естественно, обусловливает уменьшение летучести.
Алифатический эфир показывает два типа изомерии: функциональная изомерия со спиртами. Этот тип изомерии возникает из-за различий в распределении атомов углерода в виде алкильных групп вокруг атома кислорода. Эфиры могут быть получены следующими общими методами. Это соединение разлагается на соответствующие карбонильные соединения с испусканием света. Эти диоксациклобутаны ответственны за биолюминесценцию некоторых видов, таких как светлячок, солнечный свет в природе. Это также пример нуклеофильного замещения протонированным спиртом в качестве субстрата и второй молекулы спирта в качестве нуклеофила.
Спирты с низкой молекулярной массой хорошо растворимы в воде, это понятно, если учесть возможность образования водородных связей с молекулами воды (сама вода ассоциирована в очень большой степени). В метиловом спирте гидроксильная группа составляет почти половину массы молекулы; неудивительно поэтому, что метанол смешивается с водой во всех отношениях. По мере увеличения размера углеводородной цепи в спирте влияние гидроксильной группы на свойства спиртов уменьшается, соответственно понижается растворимость веществ в воде и увеличивается их растворимость в углеводородах. Физические свойства одноатомных спиртов с высокой молекулярной массой оказываются уже очень сходными со свойствами соответствующих углеводородов.
Следовательно, эфиры обладают небольшим чистым дипольным моментом. Только диметиловый эфир представляет собой газ при обычной температуре. Они легко воспламеняются. Они легче воды. Они слабо растворяются в воде, но свободно растворяются в органических растворителях, таких как спирт, хлороформ и т.д. небольшая растворимость низших эфиров в воде связана с водородной связью между молекулами воды и эфира. Реакции присоединения. Образование перекиси. Эти пероксиды нестабильны и взрываются. Поэтому перед дистилляцией следует осторожно относиться к свободным эфирам из пероксидов.
Вопрос 1. Предельные одноатомные спирты. Их строение, свойства, получение и применение.
Ответ. Одноатомные спирты – органические вещества, молекулы которых содержат одну гидроксильную групп, соединенную с углеводородным радикалом.
Присутствие пероксида можно проверить, встряхивая его водным раствором сульфата аммония и тиоцианата калия при получении красного цвета. Чтобы удалить пероксид, проба эфира должна быть промыта раствором ионов железа и дистиллирована с помощью конц. Когда эфиры хранятся в присутствии атмосферного кислорода, они медленно окисляются для получения гидропероксидов и диалкилпероксидов, оба являются взрывоопасными. Эфиры нейтральны к лакмусу, но обладают основными свойствами, поскольку они способны сочетаться с сильными минеральными кислотами, образующими оксониевую соль.
Гомология
Общая формула˸ C n H 2 n +1 OH, или R-OH.
Номенклатура
Названия спиртов производят от названий соответствующих углеводородов, прибавляя окончание ʼʼ-олʼʼ, или от названий радикалов с добавлением окончания ʼʼ-овыйʼʼ и слова ʼʼспиртʼʼ. Например˸
(этиловый спирт)
Нумеруют атомы углерода в структурной формуле спирта, начиная с того конца главной цепи, к которому ближе расположена OH – группа. Цифрой указывают атом углерода, при котором находится гидроксильная группа.
Реакции деления. Расщепление кислотами. На первой стадии расщепления образуется молекула спирта и алкилгалогенида. Метод обеспечивает хороший метод для установления структуры данного эфира. Исходной реакцией между эфиром и кислотой является образование протонированного эфира. Расщепление связано с нуклеофильной атакой галоидным ионом на протонированном эфире со смещением слабоосновной молекулы спирта. При нагревании смеси эфира и конц. Галогены реагируют с эфирами, получая продукты замещения, и степень галогенирования зависит от условий реакции.
Изомерия
Спирты ˸ первичные R-OH, вторичные R 1 -CH(OH)-R 2 , третичные R 1 -C(OH)(R 2)-R 3 .
1. Изомерия углеродного скелета ˸
CH 3 -CH 2 -CH 2 -CH 2 OH,
бутанол-1
(первичный бутиловый спирт)
CH 3 -CH-CH 2 OH,
2- метилпропанол-1
(первичный изобутиловый спирт)
CH 3 -CH 2 -CH-CH 3
бутанол-2
(вторичный бутиловый спирт)
CH 3 - C - CH 3 .
Кислород в простых эфирах, как и в спирте, является основным, т.е. его одиночная пара электронов может координировать с электронно-дефицитными металлами, такими как магний в реактивах Гриньяра. Циклические полиэфиры, которые содержат несколько функциональных групп на основе 1, 2-этандиоловой единицы, называются краун-эфирами, названными так потому, что молекулы принимают кронуобразную конформацию в кристаллическом состоянии. Например, полиэфир 18-краун-6, где число 18 относится к общему числу атомов в кольце и 6 к числу оксигенов.
Самой яркой особенностью этих краун-эфиров является их способность сольватации, в которой несколько атомов кислорода могут окружать ионы металлов. Структура краун-эфира позволяет им функционировать в качестве сильных катионных связующих, включая катионы, обнаруженные в обычных солях. Таким образом, краун-эфиры могут превращать соли, растворимые в органических растворителях. Например, перманганат калия, глубоководный фиолетовый 76, полностью нерастворимый в бензоле, готов растворяться в бензоле в присутствии 18 кун.
2-метилпропанол-2
(третичный бутиловый спирт)
2. Изомерия положения гидроксильной группы ˸
CH 3 CH 2 CH 2 OH,
пропанол-1
CH 3 CH(OH)-CH 3 .
пропанол-2
3. Межклассовая изомерия ˸
диметиловый эфир
Спирты до С 12 – жидкости, начиная с С 13 – твердые вещества, низкие температуры кипения и плавления, растворимы в воде.
Полученный раствор позволяет окислять в органических растворителях. Растворение возможно путем эффективной сольватации иона металла шестиугольными кислородом. Размер «полости» в краун-эфире может быть адаптирован для обеспечения селективного связывания только определенных катионов. Эфиры обычно используют в качестве растворителей. Кроме того, этиловый эфир ранее использовался в качестве анестезирующего средства, но теперь эти простые эфиры, такие как этиран и изофлуран, заменили его. Для использования в реакторе Гриньяра эфир должен быть свободен от следов воды и алкоголя.
Молекулы спиртов ассоциированы, поскольку между ними существуют водородные связи ˸
O-H‣‣‣ ‣‣‣ ‣‣‣O-H‣‣‣ ‣‣‣ ‣‣‣ O-H‣‣‣ ‣‣‣ ‣‣‣
1. Горение˸
2CH 3 OH + 3O 2 = 2CO 2 + 4H 2 O.
2. Взаимодействие с активными металлами ˸
2K + 2CH 3 OH = 2CH 3 OK + H 2 .
метилат калия
3. Взаимодействие с щелочами ˸
Таким образом, абсолютный эфир получают дистиллированием эфира с помощью конц. Анестезирующий эфир получают путем многократной обработки промышленного производителя растворами бисульфата натрия, карбоната натрия, промывания водой и сушки над гидроксидом натрия. Компонент-хозяин определяется как органическая молекула или ион, сайты связывания которых сходятся в комплексе, а гостевой компонент определяется как любая молекула или ион, сайты связывания которых расходятся в комплексе. Например, в иммунологии хозяин является антителом, в то время как гость является антигеном.
C 2 H 5 OH + NaOH = C 2 H 5 ONa + H 2 O.
4. Взаимодействие с галогеноводородами ˸
ROH + HBr = RBr + H 2 O.
5. Дегидратация ˸
а) при нагревании с водоотнимающим веществом ˸
C 2 H 5 OH CH 2 = CH 2 + H 2 O;
б) пропускание паров этанола над катализатором (по Лебедеву) ˸
2C 2 H 5 OH CH 2 = CH - CH = CH 2 + H 2 + 2H 2 O;
в) Получение простых эфиров ˸
C 2 H 5 OH + C 2 H 5 OH C 2 H 5 – O- C 2 H 5 + H 2 O.
Криптанды представляют собой семейство синтетических би - и полициклических мультидентатных лигандов для различных катионов. Термин криптанд подразумевает, что этот лиганд связывает субстраты в склепе, пересекая гостя, как в погребении. Эти молекулы являются трехмерными аналогами краун-эфиров, но являются более селективными и более сложными являются ионы гостя. Полученные комплексы являются липофильными. Это соединение называют криптандом, где числа указывают количество атомов эфира кислорода в каждом из трех мостиков между «шапками» аминного азота.
6. Взаимодействие с оксидом меди ˸
C 2 H 5 OH + CuO Cu + CH 3 CHO + H 2 O.
(уксусный альдегид)
7. Этерификация ˸
С 2 H 5 OH + CH 3 COOH CH 3 COO – C 2 H 5 + H 2 O.
этилацетат
Спирты дают нейтральную реакцию, в их присутствии окраска лакмуса и фенолфталеина не изменяется.
Получение
1. Щелочной гидролиз˸
C 2 H 5 Cl + KOH = C 2 H 5 OH + KCl.
2. Гидротация алкенов ˸
Комплекс между катионным гостем и криптантом называется криптатом. В отличие от типичных краун-эфиров криптанды связывают гостевые ионы с использованием доноров азота и кислорода. Криптанды более дорогие и труднее приготовить, но предлагают гораздо лучшую селективность и прочность связывания, чем другие комплексообразователи для щелочных металлов, такие как краун-эфиры. Они способны экстрагировать нерастворимые соли в органические растворители. Криптанды повышают реакционную способность анионов в солях, так как они эффективно разрушаются как ионные пары.
CH 2 = CH 2 + H 2 O C 2 H 5 OH.
3. Восстановление альдегидов ˸
CH 3 CHO + H 2 = C 2 H 5 OH.
4. Брожение глюкозы ˸
C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2 .
5. Из оксида углерода (II) и водорода ˸
CO + 2H 2 CH 3 OH.
p метанол
(древесный спирт)
6. Гидролиз крахмала и клетчатки.
Применение
1.Как сырье в производстве многих органических соединений.
2.В производстве синтетического каучука и пластмасс.
Вопрос 1. Предельные одноатомные спирты. Их строение, свойства, получение и применение. - понятие и виды. Классификация и особенности категории "Вопрос 1. Предельные одноатомные спирты. Их строение, свойства, получение и применение." 2014, 2015-2016.
